题目内容
【题目】将2.0molPCl3(g)和1.0molCl2(g)充入体积不变的密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)PCl5(g),达到平衡时,PCl5为0.40mol。如果此时移走1.0 mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
A.0.2 molB.0.4 mol
C.小于0.2 molD.大于0.20 mol,小于0.40 mol
【答案】C
【解析】
化学平衡的建立与路径无关,达到平衡后移走1.0 mol PCl3和0.50mol Cl2,可以等效为开始加入1.0 mol PCl3和0.50mol Cl2,到达的平衡,与原平衡相比压强减小,减小压强平衡向着气体分子数增加的方向移动,平衡逆向移动,反应物的转化率减小,故达到新平衡时PCl5的物质的量小于原平衡的一半,即达到新平衡时PCl5的物质的量小于0.4 mol×![]() =0.2mol;
=0.2mol;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入![]() 与
与![]() 合成尿素。在恒定温度下,混合气体中
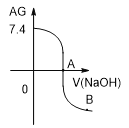
合成尿素。在恒定温度下,混合气体中![]() 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示![]() 该条件下尿素为固体
该条件下尿素为固体![]() 。A点的正反应速率
。A点的正反应速率![]() ______ B点的逆反应速率
______ B点的逆反应速率![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() ,
,![]() 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵![]() 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的![]() 和
和![]() 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:![]() 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
①上述反应的焓变:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,熵变
,熵变![]() ______
______![]() 根据表中数据,列出
根据表中数据,列出![]() 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式![]() ______
______![]() 不要求计算结果
不要求计算结果![]() 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(3)向含![]() 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______![]() 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向”![]() 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______ ![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数 ![]()
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O2![]() 2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/ mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/ mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙=丁<甲
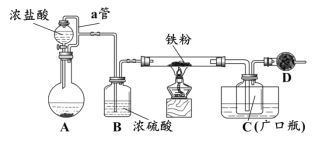
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:
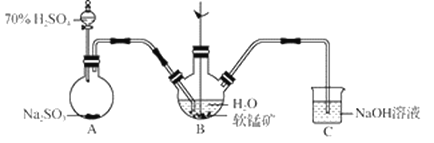
步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:

②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。