题目内容
【题目】按要求回答下列问题:
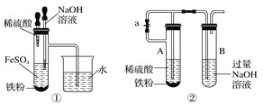
Ⅰ.(1)将NaHSO4溶液滴入到Ba(OH)2溶液中至中性的离子方程式:_______
(2)将5-6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体。写出反应的离子方程式:______________
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是____________(用离子方程式表示)。
(4)向Na2S2O3 中加入稀硫酸反应的离子方程式______________。
Ⅱ.金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物 | Cr2O | Cr(OH)3 | Cr3+ | CrO2- | CrO |
颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |
含铬元素的化合物可以发生如图一系列变化:

①写出反应④的离子方程式:___________________。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为_______。
Ⅲ.二氧化硫是常见大气污染气体,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应Na2SO3+CaO+H2O=CaSO3↓+2NaOH
若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的离子方程式____________
【答案】Ba2++2OH-+2H++![]() =BaSO4↓+2H2O Fe3++3H2O
=BaSO4↓+2H2O Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 3Fe2++
Fe(OH)3(胶体)+3H+ 3Fe2++![]() +4H+=3Fe3++NO↑+2H2O
+4H+=3Fe3++NO↑+2H2O ![]() +2H+=SO2↑+S↓+H2O 2
+2H+=SO2↑+S↓+H2O 2![]() +3H2O2+2OH-=2
+3H2O2+2OH-=2![]() +4H2O 绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液 2OH-+
+4H2O 绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液 2OH-+![]() +Br2=
+Br2=![]() +2Br-+H2O
+2Br-+H2O
【解析】
I.根据物质的性质和题中的信息,按照电荷守恒、得失电子守恒等原则书写;
II.![]() 在酸性条件下和Zn反应生成Cr3+,溶液由橙色变成绿色,Cr3+和OH-反应生成灰蓝色Cr(OH)3沉淀,Cr(OH)3在碱性条件下生成绿色的
在酸性条件下和Zn反应生成Cr3+,溶液由橙色变成绿色,Cr3+和OH-反应生成灰蓝色Cr(OH)3沉淀,Cr(OH)3在碱性条件下生成绿色的![]() ,被过氧化氢氧化为黄色的
,被过氧化氢氧化为黄色的![]() ;
;
III.从SO2的还原性、溴的氧化性考虑发生的反应;
I.(1)将NaHSO4溶液滴入到Ba(OH)2溶液中,当氢氧根离子恰好被完全中和时溶液为中性,所以离子方程式为:Ba2++2OH-+2H++![]() =BaSO4↓+2H2O;
=BaSO4↓+2H2O;
(2)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,原因是Fe3+与![]() 发生氧化还原反应生成Fe2+和
发生氧化还原反应生成Fe2+和![]() ,反应的离子方程式为:2Fe3++
,反应的离子方程式为:2Fe3++![]() +H2O=2Fe2++
+H2O=2Fe2++![]() +2H+,反应后溶液呈酸性,则在酸性条件下
+2H+,反应后溶液呈酸性,则在酸性条件下![]() 与Fe2+反应生成Fe3+,过一会又变为棕黄色,反应的离子方程式为:3Fe2++
与Fe2+反应生成Fe3+,过一会又变为棕黄色,反应的离子方程式为:3Fe2++![]() +4H+=3Fe3++NO↑+2H2O,答案为:3Fe2++
+4H+=3Fe3++NO↑+2H2O,答案为:3Fe2++![]() +4H+=3Fe3++NO↑+2H2O;
+4H+=3Fe3++NO↑+2H2O;
(4) Na2S2O3 溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫和水,反应的离子方程式为:![]() +2H+=SO2↑+S↓+H2O;
+2H+=SO2↑+S↓+H2O;
II.①绿色的![]() 被过氧化氢氧化为黄色的
被过氧化氢氧化为黄色的![]() ,过氧化氢还原后生成水,离子方程式为:2
,过氧化氢还原后生成水,离子方程式为:2![]() +3H2O2+2OH-=2
+3H2O2+2OH-=2![]() +4H2O;
+4H2O;
②向NaCrO2溶液中逐滴加入过量稀硫酸,绿色的![]() 转化为沉淀,沉淀用酸溶解生成蓝紫色Cr3+,所以现象为:绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液;
转化为沉淀,沉淀用酸溶解生成蓝紫色Cr3+,所以现象为:绿色溶液中产生灰蓝色沉淀,后沉淀溶解,产生蓝紫色的溶液;
III.向NaOH和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色,说明亚硫酸根离子被溴单质氧化为硫酸根离子,根据得失电子守恒、质量守恒,写出反应的化学方程式为:2NaOH+ Na2SO3+Br2=Na2SO4+2NaBr+H2O,对应的离子方程式为:2OH-+![]() +Br2=
+Br2=![]() +2Br-+H2O。
+2Br-+H2O。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产碳酸锂的工艺流程如下:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
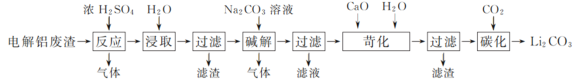
(1)含锂电解铝废渣与浓硫酸在200~400 ℃条件下反应2 h,加水浸取后过滤,得到的滤渣主要成分是________(填化学式)。
(2)流程中浸取后的过滤操作需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是________。(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40℃下进行碱解反应,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为________。
(4)苛化过程中加入的氧化钙将不溶性的碳酸锂转化成氢氧化锂溶液。若氧化钙过量,则可能会造成________。
(5)碳化反应中,CO2的吸收采用了气、液逆流的方式,这样做的优点是________。整个工艺流程中可以循环利用的物质有________。
【题目】在一定温度下,将气体X和气体Y各![]() 充入10L恒容密闭容器中,发生反应
充入10L恒容密闭容器中,发生反应![]() ,一段时间后达到平衡。反应过程中测定的数据如表:下列说法不正确的是
,一段时间后达到平衡。反应过程中测定的数据如表:下列说法不正确的是
| 2 | 4 | 7 | 9 |
|
|
|
|
|
A.反应前2min的平均速率![]()
B.其他条件不变,升高温度,反应达到新平衡前![]() 正
正![]() 逆
逆![]()
C.该温度下此反应的平衡常数![]()
D.其他条件不变,再充入![]() ,平衡时X的体积分数增大
,平衡时X的体积分数增大
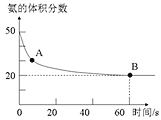
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入![]() 与
与![]() 合成尿素。在恒定温度下,混合气体中
合成尿素。在恒定温度下,混合气体中![]() 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示![]() 该条件下尿素为固体
该条件下尿素为固体![]() 。A点的正反应速率
。A点的正反应速率![]() ______ B点的逆反应速率
______ B点的逆反应速率![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() ,
,![]() 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵![]() 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的![]() 和
和![]() 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:![]() 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
①上述反应的焓变:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,熵变
,熵变![]() ______
______![]() 根据表中数据,列出
根据表中数据,列出![]() 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式![]() ______
______![]() 不要求计算结果
不要求计算结果![]() 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(3)向含![]() 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______![]() 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向”![]() 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______ ![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数 ![]()