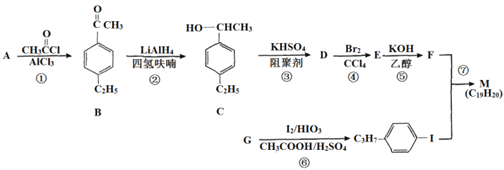
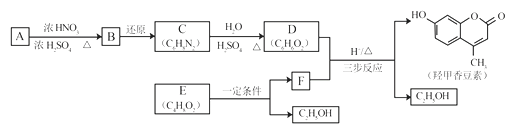
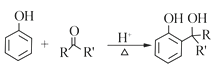
题目内容
【题目】H、C、N、O、F、Ca是六种重要的元素请根据所学的物质结构与性质的4机关知识下列问题:
(1)基态碳原子的电子排布式为__,O和F形成的化合物中原子价层都满足8电子结构的结构式是__,O元素的化合价为________.
(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于__(填“吸收”或“发射”)光谱。
(3)某药物的结构简式为![]() ,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
,财该物质中氮原子的杂化轨道类型为____,其分子之间__(填“能”或“不能”)形成氢键。
(4)CO2属于_____(填“极性”或”非极性”)分子。CO32-的空间构型为_____,与其互为等电子体的分子和离子分别为_________(各写一种)。
【答案】 1s22s22p2 F-O-F +2 发射 sp2、sp3杂化 能 非极性 平面正三角形 SO3 NO3-或SiO32-
【解析】(1)碳为6号元素,基态碳原子的电子排布式为1s22s22p2;O和F形成的化合物中原子价层都满足8电子结构的结构式是F-O-F,F的非金属性较强,显-1价,则O元素的化合价为+2价;(2)Ca在燃烧时产生红色火焰,其焰色反应看见的光属于发射光谱;(3) ![]() ,中氨基中N原子含有3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;另一个氮原子含有2个σ键,2个
,中氨基中N原子含有3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;另一个氮原子含有2个σ键,2个![]() 键,含有1对孤对电子,杂化轨道数为3,采取sp2杂化;与氨气分子相似,分子之间能形成氢键;(4)CO2原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子,属于非极性分子;C形成3个δ键,孤对电子数为
键,含有1对孤对电子,杂化轨道数为3,采取sp2杂化;与氨气分子相似,分子之间能形成氢键;(4)CO2原子间以共价键结合,分子里电荷分布均匀,正负电荷中心重合的分子,属于非极性分子;C形成3个δ键,孤对电子数为![]() (4+23×2)=0,为sp2杂化,立体构型为平面正三角形;CO32-中含一个C原子、三个O原子,带两负电荷,所以电子总数为32,与其互为等电子体的分子和离子分别为SO3、NO3-或SiO32-。
(4+23×2)=0,为sp2杂化,立体构型为平面正三角形;CO32-中含一个C原子、三个O原子,带两负电荷,所以电子总数为32,与其互为等电子体的分子和离子分别为SO3、NO3-或SiO32-。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案