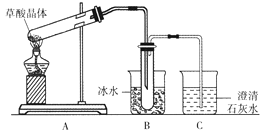
题目内容
【题目】短周期的7种元素A、B、C、D、E、F、G的原子序数依次增大,其中A原子中的电子只有1种运动状态,且与B同主族,C的基态原子2p能级上只有1个电子,F与A可形成两种常温下的液态化合物;F与G同主族。根据上述描述,请回答下列问题:
(1)上述7种元素中电负性最小的元素与A元素形成的化合物的电子式为______(用具体元素符号表示电子式),基态原子的一电离能最大的元素是_____(填元素符号)。
(2)1molD3A6链状分子中含有的σ键数为________。
(3)已知A2F2的分子结构如图所示:
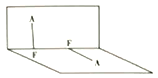
①用电离方程式表示呈弱酸性的原因:______________。
②A2F2的沸点比A2F高的原因:_______________。
【答案】 ![]() N 8NA(或4.816×1024或8×6.02×1023) H2O2
N 8NA(或4.816×1024或8×6.02×1023) H2O2![]() HO2-+H+ 因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高
HO2-+H+ 因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高
【解析】短周期的7种元素A、B、C、D、E、F、G的原子序数依次增大,其中A原子中的电子只有1种运动状态,则为氢元素,且与B同主族,则B为锂元素,C的基态原子2p能级上只有1个电子,则C为硼元素,F与A可形成两种常温下的液态化合物水和双氧水,则F为氧元素;F与G同主族,则G为硫元素。D、E处于C、F之间,只能分别为碳元素和氮元素。(1)元素非金属性越弱电解性越弱,上述7种元素中电负性最小的元素为锂元素,与A元素形成的化合物氢化锂的电子式为![]() ,同周期元素从左到右第一电离能逐渐增大,N元素的2p轨道上为半满稳定结构,第一电离能反常增大,故基态原子的第一电离能最大的元素是N;(2) C3H6链状分子为丙烯分子,每个分子中含有8个σ键和1个
,同周期元素从左到右第一电离能逐渐增大,N元素的2p轨道上为半满稳定结构,第一电离能反常增大,故基态原子的第一电离能最大的元素是N;(2) C3H6链状分子为丙烯分子,每个分子中含有8个σ键和1个![]() 键,1molC3H6链状分子中含有的σ键数为8NA;(3) ①H2O2不完全电离产生氢离子使溶液呈弱酸性H2O2
键,1molC3H6链状分子中含有的σ键数为8NA;(3) ①H2O2不完全电离产生氢离子使溶液呈弱酸性H2O2![]() HO2-+H+;②因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高。
HO2-+H+;②因为H2O2和H2O分子间都能形成氢键,而H2O2相对分子质量H2O大,H2O2分子间作用力大,沸点高。