题目内容
9.按要求回答下列问题:(1)实验室可用向CaO固体中滴加浓氨水的方法来制取NH3,请写出所涉及反应的化学方程式CaO+H2O=Ca(OH)2、NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)实验室可用加热铜和浓硫酸的方法来制备SO2,该反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,0.1mol Cu和含有0.2mol H2SO4的浓硫酸混合共热生成SO2的体积<(填“>”、“<”或“=”)2.24L(标准状况下测定),要证明上述结论,可向反应后的溶液中加入适量的bc(填字母).
a.银粉 b.铁粉
c.Na2CO3溶液 d.BaCl2溶液.
分析 (1)向CaO固体中滴加浓氨水的方法来制取NH3,CaO与水反应生成碱,且放热,使氨气逸出;
(2)铜和浓硫酸的反应生成硫酸铜、水、SO2,0.1mol Cu和含有0.2mol H2SO4的浓硫酸混合共热,若完全反应生成0.1mol气体,但随反应进行,浓硫酸变为稀硫酸,与Cu不反应,则生成气体减少,从硫酸剩余的角度分析上述结论.
解答 解:(1)向CaO固体中滴加浓氨水的方法来制取NH3,CaO与水反应生成碱,且放热,使氨气逸出,发生的反应为CaO+H2O=Ca(OH)2、NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,可利用碱石灰干燥氨气,故答案为:CaO+H2O=Ca(OH)2;NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(2)铜和浓硫酸的反应生成硫酸铜、水、SO2,反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,0.1mol Cu和含有0.2mol H2SO4的浓硫酸混合共热,若完全反应生成0.1mol气体,但随反应进行,浓硫酸变为稀硫酸,与Cu不反应,则生成气体减少,生成SO2的体积<2.24L,加铁粉或碳酸钠生成气体,氢离子剩余,证明上述结论,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;<;bc;
点评 本题考查较综合,涉及离子反应的书写,常见气体的制备等,注意氢离子剩余可说明Cu与稀硫酸不反应,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 实验室用大理石和稀盐酸制取CO2:CO32-+2H+═CO2↑+H2O | |
| B. | 碳酸钠溶液呈碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
17.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,用强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | 配合物中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | Cl-和NH3分子均参与配位 | |
| D. | Cl-没有孤对电子,NH3有孤对电子 |
4.下列说法中,正确的是( )
| A. | 酯类物质是形成水果香味的主要成分 | |
| B. | 糖类物质都具有相同的官能团 | |
| C. | 油脂的皂化反应生成高级脂肪酸和甘油 | |
| D. | 蛋白质的水解产物都含有羧基和羟基 |
1.下列电离方程式正确的是( )
| A. | H3PO4?3H++PO43- | B. | BaSO4?Ba2++SO42- | ||
| C. | Al(OH)3?H2O+AlO2-+H+ | D. | NaHS?Na++H++S2- |
18.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 碳酸钙高温下分解 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
19.某元素X的最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中,X元素的化合价为( )
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
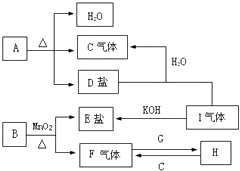 已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题:
已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题: