题目内容
3.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )| A. | Fe3+、Na+、Cl-、S2- (1:2:3:1) | B. | K+、Cu2+、OH-、SO42- (1:1:1:1) | ||
| C. | NH4+、H+、I -、HCO3- (1:1:1:1) | D. | Na+、Al 3+、Cl -、OH-(4:1:3:4) |
分析 A、Fe3+与S2-发生氧化还原反应;
B、Cu2+与OH-反应生成蓝色沉淀;
C、H+与HCO3-反应放出CO2,剩余NH4I溶液呈酸性;
D、Al3+与OH-之比为1:4,反应生成偏铝酸钠与氯化钠的混合物.
解答 解:A、Fe3+与S2-发生氧化还原反应,生成淡黄色的硫单质,故A错误;
B、Cu2+与OH-反应生成蓝色沉淀,故B错误;
C、H+与HCO3-反应放出CO2,剩余NH4I溶液呈酸性,故C错误;
D、Al3+与OH-之比为1:4,反应生成偏铝酸钠与氯化钠的混合物,偏铝酸根水解呈碱性,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
14.下列表示物质结构的化学用语或模型正确的是( )
| A. | HF的电子式: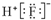 | |
| B. | 二氧化碳的结构式:O=C=O | |
| C. | Cl-离子的结构示意图: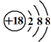 | |
| D. | 质子数为6,中子数为8的微粒:${\;}_{6}^{8}$C |
11.下列说法不正确的是( )
| A. | (CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷 | |
| B. | 某烷烃主链4个碳原子数的同分异构体有2种,则与其碳原子个数相同的且主链4个碳原子的单烯烃有4种 | |
| C. | 1mol有机物(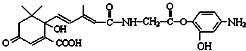 )与NaOH溶液反应,最多消耗5mol NaOH )与NaOH溶液反应,最多消耗5mol NaOH | |
| D. | 1 mol β-紫罗兰酮 ( 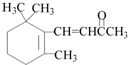 )与1 mol Br2发生加成反应可得到2种不同产物 )与1 mol Br2发生加成反应可得到2种不同产物 |
18.以下转化不能通过一步反应实现的是( )
| A. | SiO2→SiF4 | B. | Al2O3→Al(OH)3 | C. | Fe→FeCl2 | D. | SiO2→CaSiO3 |
8.对于溶液中的反应:MnO4-+5Fe2++8H+═5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是( )
| A. | 加水 | B. | 增加同浓度FeSO4溶液的用量 | ||
| C. | 向溶液中滴加稀硫酸 | D. | 加入少量KMnO4晶体 |
12.下列现象中,是因为发生加成反应而产生的现象是( )
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
13.下列能用勒夏特列原理解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |