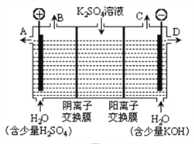
题目内容
【题目】下列叙述正确的是
A.常温下,浓硫酸不与铜反应,是因为铜被钝化
B.可用铁罐来进行储存、运输冷的浓硫酸
C.SO3具有氧化性,SO2只有还原性
D.SO2、Cl2的漂白原理相同
【答案】B
【解析】
A.浓硫酸与铜发生反应的条件是加热,常温下二者不反应,不是钝化,A项错误;
B.常温下浓硫酸使Fe快速生成致密氧化膜隔离反应物而钝化,故可以用铁罐来进行储存、运输冷的浓硫酸,B项正确;
C.SO2既具氧化性也具还原性,C项错误;
D.SO2漂白原理是SO2可与有色物质化合生成无色物质,Cl2不具备漂白性,Cl2与水反应生成的HClO具有漂白性,漂白原理是HClO具有氧化性,是氧化型漂白,D项错误;
答案选B。

练习册系列答案
相关题目
【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 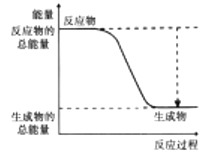 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。