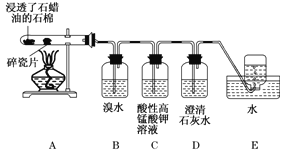
题目内容
【题目】在下图银锌原电池中,以硫酸铜为电解质溶液。

(1)锌为______极,该电极上发生的是_____________反应(“氧化”或“还原”),电极反应式为__________________________________。
(2)银为____极,电极上发生的是_______反应(“氧化”或“还原”),电极反应式是__________________,银片上观察到的现象是__________________________。
(3)该原电池的总反应式是______________________。
【答案】负 氧化反应 Zn-2e-=Zn2+ 正 还原反应 Cu2++2e-=Cu 有红色物质生成 Zn+Cu2+=Zn2++Cu
【解析】
该装置为原电池,电池的总反应式是Zn+Cu2+=Zn2++Cu,Zn是负极,Ag是正极,负极发生Zn-2e-=Zn2+,正极发生Cu2++2e-=Cu。
(1)锌为负极,该电极上发生的是氧化反应,电极反应式为:Zn-2e-=Zn2+。
(2)银为正极,电极上发生的是还原反应,电极反应式是Cu2++2e-=Cu,银片上观察到的现象是:有红色物质生成。
(3)该原电池的总反应式是:Zn+Cu2+=Zn2++Cu。

【题目】从能量的变化和反应的快慢等角度研究反应:![]() 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号)。
A.使用催化剂 B.适当提高氧气的浓度 C.适当提高反应的温度
(2)下图能正确表示该反应中能量变化的是________(填序号)。
A. 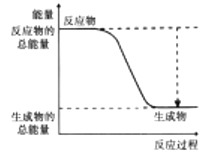 B.
B. 
(3)从断键和成键的角度分析上述反应中能量的变化。
化学键 | H—H | O=O | H—O |
键能 | 436 KJ·mol-1 | 496 KJ·mol-1 | 463 KJ·mol-1 |
请填写下表:_______________
化学键 | 填“吸收热量”或“放出热量” | 能量变化(KJ) |
拆开2molH2和1molO2中的化学键 | ①_________________ | ② KJ |
形成4molH-O键 | ③ | ④ KJ |
总能量变化 | ⑤ | ⑥ KJ |
(4)氢氧燃料电池的总反应方程式为![]() 。其中,氢气在________极发生________(“氧化”或“还原”)反应。
。其中,氢气在________极发生________(“氧化”或“还原”)反应。