题目内容
【题目】(I)某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
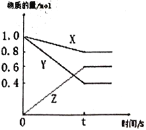
(1)写出该反应的化学反应方程式____________________________________。
(2)该温度下此反应的平衡常数______________________。
(Ⅱ).已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0请回答下列问题:
P(g)+Q(g) ΔH>0请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为___________;
(4)若反应温度升高,M的转化率_______(填“增大”“减小”或“不变”) ;
(5)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_________;
(6)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为______。
【答案】X+3Y![]() 3Z 1.725%增大641%
3Z 1.725%增大641%
【解析】
(I)(1)根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据平衡常数的定义列式计算。
(Ⅱ).依据化学平衡三段式列式计算,达到平衡后,M的转化率为60%,反应浓度=1mol·L-1×60%=0.6mol;
M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始量(mol·L-1) 1 2.4 0 0
变化量(mol·L-1) 0.6 0.6 0.6 0.6
平衡量(mol·L-1)0.4 1.8 0.6 0.6
(3)转化率=消耗量/起始量×100%;
(4)根据温度对平衡的影响分析,反应吸热,升高温度平衡右移;
(5)由于温度不变,则平衡常数不变,与(3)相同;
(6)设平衡时转化的M为xmol,由于温度不变,则平衡常数不变,与(3)相同.
(I)(1)由图象可知,反应达到平衡时,△n(X):△n(Y):△n(Z)=0.2mol:0.6mol:0.6mol=1:3:3,则反应的方程式为X+3Y![]() 3Z;
3Z;
(2)平衡时浓度分别为c(X):0.8mol/2L=0.4mol/L,c(Y):0.4mol/2L=0.2mol/L,c(Z):0.6mol/2L=0.3mol/L,k=![]() =1.7;
=1.7;
(Ⅱ).达到平衡后,M的转化率为60%,反应浓度=1mol·L-1×60%=0.6mol;
M(g)+N(g)![]() P(g)+Q(g)
P(g)+Q(g)
起始量(mol·L-1) 1 2.4 0 0
变化量(mol·L-1) 0.6 0.6 0.6 0.6
平衡量(mol·L-1)0.4 1.8 0.6 0.6
K=![]() =0.5
=0.5
(3)N的转化率=消耗量/起始量×100%=0.6mol·L-1/2.4mol·L-1×100%=25%;
(4)反应吸热,升高温度平衡右移,则M的转化率增大;
(5)根据相同温度时平衡常数不变求解,
M(g) + N(g)![]() P(g) + Q(g);△H<0
P(g) + Q(g);△H<0
起始量4mol·L-1 amol·L-1 0 0
变化量2mol·L-1 2mol·L-1 2mol·L-1 2mol·L-1
平衡量2mol·L-1 (a-2)mol·L-1 2mol·L-1 2mol·L-1
由于温度不变,则平衡常数不变,与(3)相同,则有:![]() =0.5,解之得a=6;
=0.5,解之得a=6;
(6)设平衡时转化的M为xmol,
M(g) + N(g)![]() P(g)+ Q(g);△H<0
P(g)+ Q(g);△H<0
起始量bmol·L-1 bmol·L-1 0 0
变化量xmol·L-1 xmol·L-1 xmol·L-1 xmol·L-1
平衡量(b-x) mol·L-1 (b-x)mol·L-1 xmol·L-1 xmol·L-1
由于温度不变,则平衡常数不变,与(3)相同,则有:
![]() ,则
,则![]() 0.414=41.4%,
0.414=41.4%,
故答案为:41.4%.