题目内容
【题目】向200mL FeBr2溶液中逐渐通入C12,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )
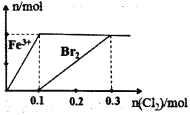
A.氧化性强弱:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1molL─1
C.n(Cl2)= 0.12 mol时,溶液中的离子浓度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1时,反应的离子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
【答案】C
【解析】
A.由图可知,氯气先氧化亚铁离子,后氧化溴离子,则还原性:Fe2+<Br-,则氧化性强弱:Br2>Fe3+,故A正确;
B.图中通入0.1mol氯气时亚铁离子完全被氧化生成0.2molFe3+,由Fe原子守恒及c=![]() 可知该FeBr2溶液的浓度为
可知该FeBr2溶液的浓度为![]() =1molL1,故B正确;
=1molL1,故B正确;
C.n(Cl2)=0.12mol时,0.1mol氯气使亚铁离子完全被氧化生成0.2molFe3+,由2Br-+Cl2=2Cl-+Br2可知,0.02molCl2氧化0.04molBr-,溶液中的离子浓度有c(Fe3+):c(Br-)=0.2mol:(0.4mol-0.04mol)=5:9,故C错误;
D.n(FeBr2):n(Cl2)=1:1时,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化,则反应的离子方程式为2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D正确;
故选:C。

练习册系列答案
相关题目