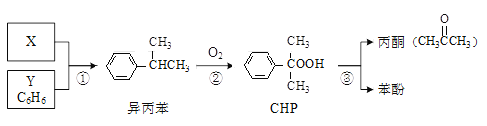
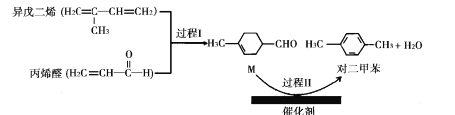
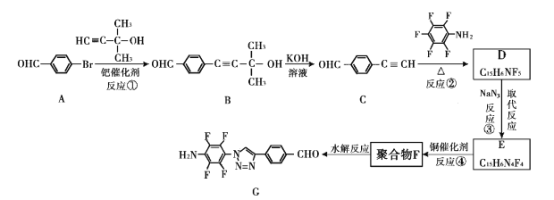
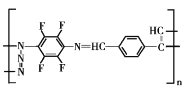
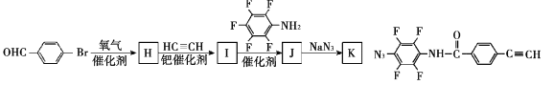
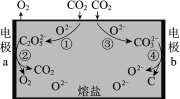
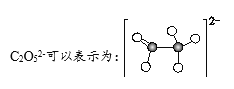
题目内容
【题目】氢氧燃料电池常用于航天飞船,由电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
当得到1.8 kg饮用水时,电池内转移电子的物质的量为
A.1.8 mol
B.3.6 mol
C.100 mol
D.200 mol
【答案】D
【解析】
由电池的正、负极反应可得出电池的总反应为2H2+O2=2H2O,每转移4 mol电子,产生2 mol H2O,现n(H2O)=100mol,则转移电子的物质的量为2×100 mol=200 mol。
已知:负极:2H2+4OH--4e-=4H2O,正极:O2+2H2O+4e-=4OH-,正极反应和负极反应相加可以得到电池的总反应为2H2+O2=2H2O,根据化学方程式,产生2 mol H2O,转移4 mol电子,得到1.8 kg饮用水的物质的量为n=![]() =100mol,则转移电子的物质的量为
=100mol,则转移电子的物质的量为![]() mol=200 mol。
mol=200 mol。
答案为D。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目