题目内容
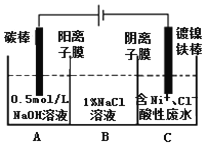
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是

A.O2在b极得电子,最终被还原为![]()
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,![]() 经“交换膜2”移向b极
经“交换膜2”移向b极
D.H2参与的电极反应为:![]()
【答案】C
【解析】
在燃料电池中,通入O2的电极为正极,即b极为正极,a极为负极。
A. O2在b极得电子,生成的O2-与CO2反应,最终O2被还原为![]() ,A正确;
,A正确;
B. 放电过程中,电子由负极经导线流向正极,即由电极a经导线流向电极b,B正确;
C. 该电池工作时,因为b极不断生成![]() ,所以
,所以![]() 经“交换膜2”移向左侧,C错误;
经“交换膜2”移向左侧,C错误;
D. H2在负极失电子生成H+,与CO32-结合生成水和二氧化碳气体,参与的电极反应为:![]() ,D正确。
,D正确。
故选C。

【题目】滴定是一种化学实验操作也是一种定量分析的手段。它通过两种溶液的定量反应来确定某种溶质的含量。实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,其操作过程为:
①准确称取2.040g邻苯二甲酸氢钾加入250mL锥形瓶中;
②向锥形瓶中加30mL蒸馏水溶解;
③向溶液中加入1~2滴指示剂;
④用氢氧化钠溶液滴定至终点;
⑤重复以上操作;
⑥根据两次实验数据计算氢氧化钠的物质的量的浓度。
已知:Ⅰ、到达滴定终点时,溶液的pH值约为9.1。
Ⅱ、邻苯二甲酸氢钾在水溶液中可以电离出一个H+
Ⅲ、邻苯二甲酸氢钾的相对分子质量为204
指示剂 | 酚酞 | 甲基橙 | ||||
pH范围 | <8.2 | 8.2 ~ 10 | >10 | <3.1 | 3.1 ~ 4.4 | >4.4 |
颜色 | 无色 | 粉红色 | 红色 | 红色 | 橙色 | 黄色 |
(1)为标定氢氧化钠溶液的浓度,应选用___________作指示剂;
(2)判断到达滴定终点的实验现象是___________________________________________;
(3)滴定结束消耗NaOH溶液体积为10.00ml,则NaOH溶液的浓度为______________;
(4)滴定过程中,下列操作能使测定结果(待测液的浓度数值)偏小的是_________。
A.上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解
B.滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失
C.滴定完毕,尖嘴外留有液滴或溶液滴在锥形瓶外
D.滴定前仰视读数而滴定终了俯视读数