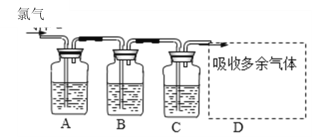
题目内容
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)若取a g样品,向其中加入足量的氢氧化钠溶液,测得生成的气体(标准状况,下同)体积为b L,样品中铝的质量是______________g。
(2)若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是:_______________________,氧化铁与铝的质量比是_____________。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比c:b__________。
(4)用铝热法还原下列物质,制得金属各1mol,消耗铝最少的是____________
A.MnO2 B.Fe3O4 C.Cr2O3 D. V2O5
【答案】0.8b 2Al+Fe2O3![]() Al2O3+2Fe 80:27 2:3 B
Al2O3+2Fe 80:27 2:3 B
【解析】
(1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,根据氢气的体积计算铝的质量;
(2)铝与氧化铁在高温下生成铁与氧化铝;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比;
(3)由方程式可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比.注意铁与盐酸反应生成氯化亚铁;
(4)根据化合价的变化判断,化合价变化的数值越小,说明发生氧化还原反应时得到的电子数目越少,则消耗铝的量最少。
(1)氧化铁和氢氧化钠溶液不反应,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式知,铝的质量=![]() ×
×![]() ×27g/mol=
×27g/mol=![]() g;
g;
(2)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为:2Al+Fe2O3![]() 2Fe+Al2O3;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比,则样品中氧化铁与铝的质量比为(56×2+16×3):2×27=80:27;
2Fe+Al2O3;由二者恰好反应,根据方程式可知,质量之比等于总的相对分子质量之比,则样品中氧化铁与铝的质量比为(56×2+16×3):2×27=80:27;
(3)由方程式2Al+Fe2O3![]() 2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3;
2Fe+Al2O3可知,(2)中生成的n(Fe)等于铝热剂中n(Al),与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,所以(3)中生成的氢气与(1)中生成氢气体积之比c:b=2n(Fe):3n(Al)=2:3;
(4)A.MnO2~Mn,生成1molMn,需要得到4mol电子,消耗![]() molAl;
molAl;
B.Fe3O4~3Fe,生成1molFe得到![]() mol电子,消耗
mol电子,消耗![]() molAl;
molAl;
C.Cr2O3~2Cr,生成1molCr,需要3mol电子,消耗1molAl;
D.V2O5~2V,生成1molV,需得电子5mol,消耗![]() molAl;
molAl;
所以制得金属各1mol,消耗铝最少的是B,故答案为B。

【题目】![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
元素 |
|
|
|
|
原子半径( | 0.077 | 0.070 | 0.104 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.![]() 与
与![]() 形成的化合物的电子式可表示为
形成的化合物的电子式可表示为![]()
B.![]() 的氢化物能与
的氢化物能与![]() 的氢化物反应,所得产物只含有共价键
的氢化物反应,所得产物只含有共价键
C.![]() 、
、![]() 能分别与氧元素形成多种氧化物
能分别与氧元素形成多种氧化物
D.![]() 处于元素同期中第三周期ⅣA族
处于元素同期中第三周期ⅣA族