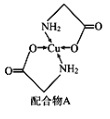
题目内容
【题目】下列离子方程式的书写正确的是( )
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.氯气通入NaOH溶液中:2OH-+Cl2=Cl-+ClO-+H2O
C.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D.AlC13溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
【答案】B
【解析】
A.用FeCl3溶液腐蚀印刷电路板,反应生成氯化亚铁和氯化铜,正确的离子方程式为2Fe3++Cu=2Fe2++Cu2+,故A错误;
B.氯气通入NaOH溶液中,反应的离子方程式为2OH﹣+Cl2=Cl﹣+ClO﹣+H2O,故B正确;
C.铁和稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为Fe+2H+=Fe2++H2↑,故C错误;
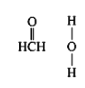
D.氯化铝与氨水反应生成氯化铵和氢氧化铝沉淀,正确的离子方程式为Al3++3NH3H2O=Al(OH)3↓+![]() ,故D错误;
,故D错误;
故答案为B。

【题目】三氯氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂。实验室制取POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。采用氧气氧化液态PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
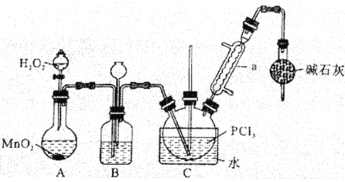
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体;遇水均剧烈水解为含氧酸和氯化氢;两者互溶。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为______。
(2)装置C中生成POCl3的化学方程式为__________。
(3)装置B的作用除观察O2的流速之外,还有_________、________。
(4)反应温度应控制在60-65℃之间,原因是__________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①实验Ⅰ结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725gPOCl3,产品,置于盛60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol·L-1AgNO3溶液,使氯离子完全沉淀;向其中加入少量硝基苯并用力摇动。
③以硫酸铁溶液为指示剂,用0.2 mol·L-1KSCN溶液滴定过量的AgNO3溶液,达滴定终点时共用去10.00mLKSCN溶液。
己知:Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN)。
(5)达滴定终点时的现象为____________。
(6)实验过程中加入硝基苯的目的是__________;若无此操作,则所测POCl3的含量将____________(填“偏高”、“偏低”或“不变”)。
(7)测得产品POCl3的百分含量为________(保留三位有效数字)。