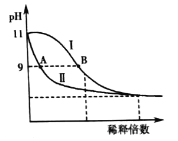
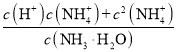题目内容
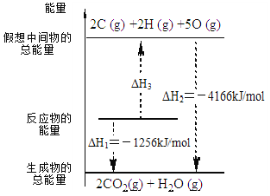
【题目】电石气是一种常见燃料,C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH 有关化学反应的能量变化如右图所示,已知断裂1mol化学键所需的能量(kJ):O=O为500、C-H为410,则断裂1molC≡C 键所需的能量(kJ)是
A.840B.1590C.900D.1250
【答案】A
【解析】
根据热化学方程式的含义可知:旧键断裂所吸收的能量和新键生成所释放的能量之差即为化学反应焓变的数值,结合图示内容来回答即可.
根据图中内容,可以看出C2H2(g) + 5/2 O2(g) = 2CO2(g) + H2O(l) ΔH =-1256kJ/mol
则C2H2(g) + 5/2 O2(g)==2C+2H+5O △H=4166-1256=2910kJ/mol
化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molC≡C 键所需的能量为K,旧键断裂吸收的能量:154+4K+500=2218,解得K=391.
410![]() 2+K+2.5
2+K+2.5![]() 500=2910 kJ/mol
500=2910 kJ/mol
K=2910-410![]() 2-2.5
2-2.5![]() 500==840 kJ/mol
500==840 kJ/mol
故选A。

【题目】Co3O4是制备石墨烯电池正极材料LiCoO2的原料。以钴矿石(主要成分为Co3S4,含有少量FeO、Fe2O3、Al2O3等杂质)为原料制取Co3O4的工艺流程如图:
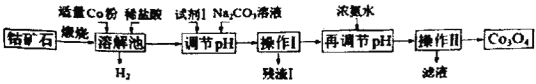
己知:Co与Fe为活泼金属,氧化性由强到弱的顺序为:Co3+>Fe3+>Co2+。
几种氢氧化物的溶度积如下表:
氢氧化物 | Co(OH)2 | Fe(OH)2 | Co(OH)3 | Al(OH)3 | Fe(OH)3 |
溶度积(Ksp) | 2.0×10-15 | 8.0×10-16 | 2.0×10-44 | 1.3×10-33 | 4.0×10-39 |
下列有关说法错误的是
A.溶解池中生成H2的离子反应方程式为:Co+2H+=Co2++H2↑
B.加入试剂1的目的是将Fe2+氧化为Fe3+,试剂1可选用双氧水或碘水
C.残渣1的主要成分为Fe(OH)3
D.操作Ⅱ包括过滤、洗涤、干燥和灼烧四个步骤