题目内容
【题目】氢氧燃料电池的工作原理如图所示。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式[当解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
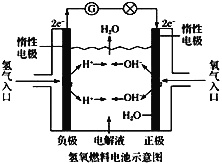
(1)酸式电池的电极反应:
负极:____,
正极:____。
电池总反应:____。
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
(2)碱式电池的电极反应:
负极:____,
正极:____;
电解质溶液pH的变化___(填“变大”、“变小”或“不变”)。
【答案】2H2-4e-=4H+ O2+4e-+4H+=2H2O 2H2+O2=2H2O 变大 2H2-4e-+4OH-=4H2O O2+4e-+2H2O=4OH- 变小
【解析】
氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,总反应为2H2+O2=2H2O;随着酸碱环境的不同,两极极反应方程式也不同,据此进行分析。
(1)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,酸性溶液中负极反应为:2H2-4e-=4H+,通入氧气的一极为原电池的正极,发生还原反应,酸性溶液中正极反应为:O2+4e-+4H+=2H2O,电池总反应为2H2+O2=2H2O;反应生成水,溶液氢离子浓度降低,pH增大;
故答案为:2H2-4e-=4H+ ;O2+4e-+4H+=2H2O;2H2+O2=2H2O;变大;
(2)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,通入氧气的一极为原电池的正极,发生还原反应,碱性溶液中正极反应为O2+4e-+2H2O=4OH-,电池总反应为2H2+O2=2H2O;反应生成水,溶液氢氧根离子离子浓度降低,pH减小;
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;变小。