题目内容
18.铜与过量的浓硝酸反应,当有0.2mol硝酸被还原时,参加反应的铜为( )| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
分析 发生Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O,有0.2mol硝酸被还原时,得到电子为0.2mol×(5-4)=0.2mol,Cu失去电子,结合电子守恒计算.
解答 解:发生Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O,有0.2mol硝酸被还原时,得到电子为0.2mol×(5-4)=0.2mol,Cu失去电子,
由电子守恒可知,Cu的物质的量为$\frac{0.2mol}{(2-0)}$=0.1mol,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.将4 g NaOH溶解于水配成1L溶液,从中取出10mL,这10mL溶液的物质的量浓度是( )
| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |
3.相同条件下,将1体积的CO和2体积的CO2混合,混合气体中碳、氧原子个数之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:5 |
10.将少量的金属钠投入到过量的AlCl3溶液中,产生的现象是( )
| A. | 只有气体产生 | B. | 生成白色沉淀 | ||
| C. | 生成无色透明溶液 | D. | 产生气体和白色沉淀 |
7.现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x.将此合金研成粉末状后全部投入含bmolHNO3的稀溶液中,微热使其充分反应,HNO3还原产物只得到NO.
(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a,x表示)$\frac{8a(1-x)}{3}$<b≤$\frac{8a}{3}$.
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
8.一定条件下,某密闭容器中充入等物质的量的A、B两种气体,发生反应:A(g)+B(g)═2C(g).达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )
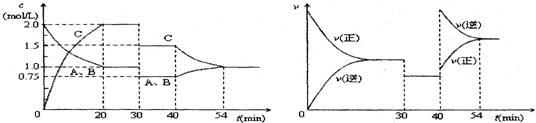

| A. | 30min时减小容积 | |
| B. | 40min时加入催化剂 | |
| C. | 0~20min内A的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 正反应为吸热反应 |
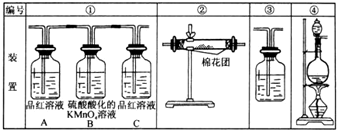 (1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O