题目内容
6. (1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
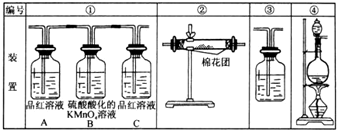
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O(2)试用如图所示各装置设计一个实验,来验证上述反应所产生的各种产物.这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):④→②→①→③.
(3)实验时可观察到装置①中A瓶的溶液褪色.A瓶溶液的作用是验证产物气流中是否有SO2,B瓶溶液的作用是将SO2全部氧化吸收,可用过氧化氢代替,C瓶溶液的作用是确定产物中SO2已被B瓶溶液全部氧化.
(4)装置②中所加的固体药品是无水硫酸铜,可验证的产物是水蒸气,确定装置②在整套装置中位置的理由是若在①、③后则无法检验水是否是生成物.
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是二氧化碳.
(6)如果按照①②③的顺序连接,可以检出的物质是CO2、SO2,不能检出的是H2O;
如果按照②③①的顺序连接,可以检出的物质是H2O,不能检出的是CO2、SO2;
如果按照①③②的顺序连接,可以检出的物质是SO2、CO2,不能检出的是H2O.
分析 (1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水;
(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳;
(3)可以用品红来检验溶液是否褪色,并可以用品红来检验二氧化硫是否除尽;
(4)可以用无水硫酸铜来检验水的产生,根据二氧化碳和二氧化硫的检验试剂来确定水的检验的位置;
(5)可以用澄清石灰水检验二氧化碳的存在;
(6)将混合气体通过某种水溶液之后,再检验水的存在与否是错误的,因为这些水溶液中含有水;二氧化碳和二氧化硫均可以使澄清的石灰水变浑浊.
解答 解:(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,即C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O;
(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳,故答案为:④→②→①→③;
(3)根据检验的顺序,在检验二氧化碳之前先检验二氧化硫,可以用品红来检验,除二氧化硫可以用高锰酸钾,也可以用氧化剂过氧化氢氧化二氧化硫,二氧化硫是否被高锰酸钾吸收干净,也可以用品红来检验,
故答案为:验证产物气流中是否有SO2;将SO2全部氧化吸收;过氧化氢;确定产物中SO2已被B瓶溶液全部氧化;
(4)以用无水硫酸铜来检验水的产生,检验二氧化碳和二氧化硫时用到的溶液中均含有水,产物气流通过①、③会带出水蒸气,所以先检验水的存在,确定装置②在整套装置中位置的理由是若在①、③后则无法检验水是否是生成的水;
故答案为:无水硫酸铜;水蒸气;若在①、③后则无法检验水是否是生成物;
(5)可以用澄清石灰水检验二氧化碳的存在,故答案为:澄清石灰水;二氧化碳;
(6)通入品红溶液带来水蒸气,所以不能证明水蒸气的存在;可以确定水的存在,但是③既可以是二氧化碳的性质又可以是二氧化硫的性质,而且二种气体全部被吸收,故答案为:CO2、SO2;H2O;H2O;CO2、SO2;SO2、CO2;H2O.
点评 本题考查学生浓硫酸的性质中的和碳单质的反应,注意产物检验所用的试剂以及检验的先后顺序知识,综合性较强,难度大.

 $\stackrel{CH_{2}(COOH)_{2}}{→}$
$\stackrel{CH_{2}(COOH)_{2}}{→}$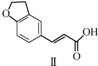 $→_{H_{2}}^{Pd-C}$
$→_{H_{2}}^{Pd-C}$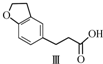
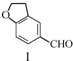
| A. | 不能用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有10种 |
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 铝片不用特殊方法保存 | |
| C. | 纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快 | |
| D. | 镀锌铁不如镀锡铁耐用 |
| A. | 化合物电离时,生成的阳离子是氢离子的是酸 | |
| B. | 化合物电离时,生成的阴离子是氢氧根离子的是碱 | |
| C. | 化合物电离时,生成金属阳离子和酸根离子的是盐 | |
| D. | NH4Cl是盐 |
| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
| A. | m>n | B. | m=n | C. | m<n | D. | 无法判断 |
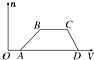 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.