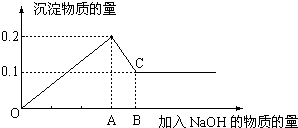
题目内容
4.SO2溶于水发生反应是SO2+H2O=H2SO3,向放置在空气中一段时间的亚硫酸溶液中加入BaCl2溶液,有白色沉淀生成,过滤后,向白色沉淀中加入盐酸,发现只有部分溶解,则此白色沉淀的成分是BaSO3、BaSO4,则亚硫酸在空气中发生反应的方程式是2H2SO3+O2=2H2SO4,白色沉淀溶于盐酸的离子方程式BaSO3+2H+=Ba2++SO2↑+H2O,上述事实说明亚硫酸的两个性质分别是酸性、还原性.分析 二氧化硫可与水反应生成亚硫酸,为化合反应,亚硫酸具有还原性,可被氧化为硫酸,亚硫酸钡可溶于盐酸,以此解答该题.
解答 解:二氧化硫可与水反应生成亚硫酸,发生SO2+H2O=H2SO3,亚硫酸具有还原性,可被氧化为硫酸,发生2H2SO3+O2=2H2SO4,与氯化钡反应生成沉淀为BaSO3、BaSO4,亚硫酸钡可溶于盐酸,发生BaSO3+2H+=Ba2++SO2↑+H2O,说明亚硫酸具有酸性和还原性,
故答案为:SO2+H2O=H2SO3;BaSO3;BaSO4;2H2SO3+O2=2H2SO4;BaSO3+2H+=Ba2++SO2↑+H2O;酸性;还原性.
点评 本题考查了二氧化硫的化学性质,为高频考点,侧重二氧化硫酸性氧化物及还原性的考查,注意亚硫酸的酸性和还原性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列有关工业生产叙述正确的是( )
| A. | 电解精炼铜时,将粗铜与电源的负极相连 | |
| B. | 合成氨工业中,将NH3及时液化分离有利于加快反应速率 | |
| C. | 氯碱工业中,烧碱在阳极区生成 | |
| D. | 工业上通常使用电解法制备金属钠、镁、铝等 |
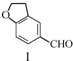
12.雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法正确的是( )
 $\stackrel{CH_{2}(COOH)_{2}}{→}$
$\stackrel{CH_{2}(COOH)_{2}}{→}$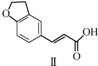 $→_{H_{2}}^{Pd-C}$
$→_{H_{2}}^{Pd-C}$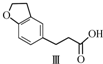
 $\stackrel{CH_{2}(COOH)_{2}}{→}$
$\stackrel{CH_{2}(COOH)_{2}}{→}$ $→_{H_{2}}^{Pd-C}$
$→_{H_{2}}^{Pd-C}$
| A. | 不能用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有10种 |
19.化学与人们的生活、生产息息相关,下列说法正确的是( )
| A. | 无论使用的石油、煤等传统能源,还是氢能、核能等新能源,归根结底这些能源都是由太阳能转而来 | |
| B. | 铝表面有一层致密的氧化物薄膜具有极强的抗腐蚀能力,故铝制容器可用来贮存酸碱性、腌制性食品等 | |
| C. | 生活中用草木灰制作松花蛋,农业上用福尔马林浸种,工业上用亚硝酸盐处理皮革等,其过程的共同点都是利用了蛋白质变性的性质 | |
| D. | 氯气、次氯酸盐、二氧化氯等含氯化合物都具有强氧化性,能用于杀菌消毒.氯化钾、氯酸钾也是含氯化合物,故也能用于杀菌消毒 |
9.下列有关物质的性质和该性质的应用均正确的是( )
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 油脂在碱性条件下易水解,可用于制作肥皂 | |
| C. | 次氯酸钠具有强还原性,可用于配制“84”消毒液 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
18.铜与过量的浓硝酸反应,当有0.2mol硝酸被还原时,参加反应的铜为( )
| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
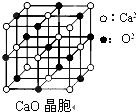 [物质结构与性质]可以由下列反应合成三聚氰胺:
[物质结构与性质]可以由下列反应合成三聚氰胺: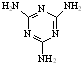 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(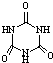 )后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.
)后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.