题目内容
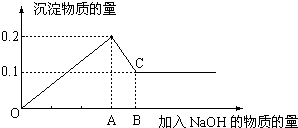
7.现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x.将此合金研成粉末状后全部投入含bmolHNO3的稀溶液中,微热使其充分反应,HNO3还原产物只得到NO.(1)用粒子符号填写下列空白(列举出全部可能出现的情况).
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,在标准状况下共产生672mlNO气体.求a和b的值a=0.04mol,b=0.12mol.
分析 (1)Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属剩余时可能是Fe、Cu或者只有Cu,根据剩余固体的成分结合物质还原性强弱、离子共存分析;
(2)当溶液中的金属离子只有Fe2+、Cu2+时,说明Cu恰好完全反应或者有剩余,而HNO3和Fe则完全反应(如果有硝酸剩余,则Fe2+则会被进一步氧化为Fe3+;如果有Fe剩余,则会和Cu2+继续反应),
HNO3→NO,N得3电子,设被还原的HNO3为y mol,总计得3y mol电子,
Cu→Cu2+,Cu失2电子,设参加反应的Cu为z mol,总计失2z mol电子,
Fe→Fe2+,Fe失2电子,参加反应的Fe为a(1-x) mol,总计失2a(1-x) mol电子,
根据得失电子总数相等,所以:3y=2z+2a(1-x) ①
反应中起酸作用的硝酸生成Fe(NO3)2和Cu(NO3)2,起氧化剂作用的硝酸生成NO,由N元素守恒,所以有:y+2a(1-x)+2z=b ②
联立方程,消去y,可得b的表达式(用a、x、z表示),参加反应的Cu的物质的量z的取值大于0,最大为ax,带入b的表达式计算.
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,Cu全部为铜离子,根据得失电子守恒和氮原子守恒计算.
解答 解:(1)Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属可能有剩余时,根据共存可知,剩余金属有两种情况:①剩余Fe、Cu,当有Fe剩余时,溶液中能与Fe反应的Fe3+、Cu2+都不存在,所以溶液中只有Fe2+;
②只剩余Cu,溶液中一定不存在与Cu反应的Fe3+,根据离子共存,可能只有Fe2+;
③通过②知,溶液中还可能存在的离子是Fe2+、Cu2+;
④当固体没有剩余时,可能存在的情况是:当Fe恰好与硝酸反应生成Fe2+,Cu 恰好与硝酸生成Cu2+,所以溶液中存在的离子是Fe2+、Cu2+;
⑤通过④知,固体没有剩余时,生成的Fe3+部分反应,根据离子共存,溶液中存在的离子可能的Fe2+、Fe3+、Cu2+;
⑥通过④、⑤知,固体没有剩余时,铁、铜全部被氧化成离子,根据离子共存,溶液中存在的离子可能是Cu2+、Fe3+;
故答案为:
| 组序 成分 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 残留固体成分 | Fe、Cu | Cu | Cu | |||
| 溶液中的金属离子 | Fe2+ | Fe2+ | Fe2+、Cu2+ | Fe2+、Cu2+ | Fe2+、Fe3+、Cu2+ | Cu2+、Fe3+ |
HNO3→NO,N得3电子,设被还原的HNO3为y mol,总计得3y mol电子,
Cu→Cu2+,Cu失2电子,设参加反应的Cu为z mol,总计失2z mol电子,
Fe→Fe2+,Fe失2电子,参加反应的Fe为a(1-x) mol,总计失2a(1-x) mol电子,
根据得失电子总数相等,所以:3y=2z+2a(1-x) ①
反应中起酸作用的硝酸生成Fe(NO3)2和Cu(NO3)2,起氧化剂作用的硝酸生成NO,由N元素守恒,所以有:y+2a(1-x)+2z=b ②
联立方程,消去y,整理得b=$\frac{4[2z+2a(1-x)]}{3}$③
参加反应的Cu的物质的量z的取值大于0,最大为ax,带入③中,可得$\frac{8a(1-x)}{3}$<b≤$\frac{8a}{3}$,
故答案为:$\frac{8a(1-x)}{3}$<b≤$\frac{8a}{3}$;
(3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等时,Cu全部为铜离子,所以参加反应的Cu为0.5amol,Fe3+和Fe2+的物质的量各为0.25amol,
HNO3→NO,N得3电子,产生672mlNO气体即0.03mol,总计得0.09 mol电子,
Cu→Cu2+,Cu失2电子,则失a mol电子,
Fe→Fe2+,Fe失2电子,则失0.5amol电子,
Fe→Fe3+,Fe失3电子,则失0.75amol电子,
根据得失电子总数相等,所以:0.09=a+0.5a+0.75a,解得a=0.04,
根据氮原子守恒可知:b=2n(Cu2+)+2n(Fe2+)+3n(Fe3+)+2n(NO)=2×0.04×0.5+2×0.04×0.25+3×0.04×0.25+0.03=0.12mol;
故答案为:a=0.04mol;b=0.12mol.
点评 本题考查了铁、铜及硝酸的性质,因为铁是变价金属,和硝酸反应又涉及量不同产物不同,所以本题难度较大,可根据固体成分结合离子共存讨论,化繁为简,效果较好.

| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
| A. | m>n | B. | m=n | C. | m<n | D. | 无法判断 |
| A. | MgO+Al | B. | 电解熔融的MgCl2 | C. | 加热MgCl2 | D. | MgO+C(高温) |
| A. | 工业上大量含硫燃料的燃烧 | B. | 工业生产使空气中CO2含量增加 | ||
| C. | SO2在尘埃催化下氧化为SO3 | D. | SO3与水反应生成H2SO4 |
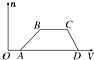 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题. 制取
制取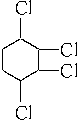 ,其合成流程如下:
,其合成流程如下: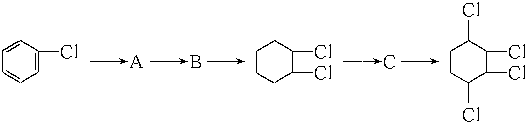
 这两步反应的化学方程式.
这两步反应的化学方程式.