题目内容
9.将4 g NaOH溶解于水配成1L溶液,从中取出10mL,这10mL溶液的物质的量浓度是( )| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |
分析 溶液是均匀的,从稀释后的1L溶液中取出10mL溶液,该10mL溶液与1L溶液的物质的量浓度相等,根据c=$\frac{n}{V}$计算1L溶液中氢氧化钠的物质的量浓度.
解答 解:4gNaOH的物质的量=$\frac{4g}{40g/mol}$=0.1mol,稀释成1L的溶液后,氢氧化钠的物质的量浓度=$\frac{0.1mol}{1L}$=0.1mol/L,溶液是均匀的,从稀释后的1L溶液中取出10mL溶液,该10mL溶液与1L溶液的物质的量浓度相等为0.1mol/L,故选:B.
点评 本题主要考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
14.下列事实能用电化学理论解释的是( )
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 铝片不用特殊方法保存 | |
| C. | 纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快 | |
| D. | 镀锌铁不如镀锡铁耐用 |
1.(双选)关于酸、碱、盐的下列各种说法中,正确的是( )
| A. | 化合物电离时,生成的阳离子是氢离子的是酸 | |
| B. | 化合物电离时,生成的阴离子是氢氧根离子的是碱 | |
| C. | 化合物电离时,生成金属阳离子和酸根离子的是盐 | |
| D. | NH4Cl是盐 |
18.铜与过量的浓硝酸反应,当有0.2mol硝酸被还原时,参加反应的铜为( )
| A. | 0.05mol | B. | 0.1mol | C. | 0.2mol | D. | 0.04mol |
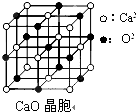 [物质结构与性质]可以由下列反应合成三聚氰胺:
[物质结构与性质]可以由下列反应合成三聚氰胺: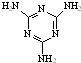 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(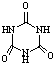 )后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.
)后,三聚氰酸与三聚氰胺分子相互之间通过分子间氢键结合,在肾脏内易形成结石.
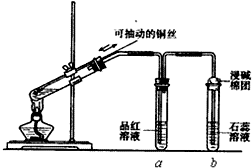 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.