题目内容
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
A.烧杯 B.表面皿 C.坩埚 D.酒精灯 E.圆底烧瓶
(2)请写出步骤④中反应的离子方程式:
(3)步骤⑥是从含碘的苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出并改正下列实验装置中的错误之处(至少两处)。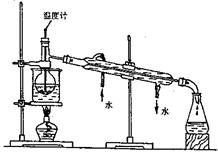
①
②
(4)步骤⑤中,某学生选择用苯来提取碘,其验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将分液漏斗上口倒出上层溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。就此实验,完成下列填空:
①正确操作步骤的顺序是 → → →A→G→ →E→F
②上述(G)步骤操作的目的是
③能选用苯从碘水中萃取碘的原因是
(1)C D(2分) (2)2I—+Cl2=I2+2Cl_(2分)
(3)①温度计水银球位置没有放在蒸馏烧瓶的支管口。正确做法应将温度计水银球的上限与蒸馏烧瓶支管口的下限对齐。
②冷凝管中的水流方向错误。正确做法应是上进下出
③烧杯不能直接加热。正确做法应该垫上石棉网(任写两处,共4分)
(4)① C → B → D →A→G→ H →E→F(2分)
②与大气相通,使液体顺利流下(2分)
③苯与水互不相溶且不反应;I2在苯中溶解度比在水中的大;苯与碘互不反应。(2分,漏写一点给扣1分,错写或漏写两点以上不给分)
解析试题分析:(1)灼烧是在高温下进行的,因此选用坩埚来作反应的容器。除了坩埚,还得选用酒精灯。 (2)步骤④是用氯气将溶液中的碘离子置换成碘单质:2I—+Cl2=I2+2Cl-(2分)
(3)①若像装置中这样插入液体中,测的是反应液的温度,温度计水银球位置没有放在蒸馏烧瓶的支管口。正确做法应将温度计水银球的上限与蒸馏烧瓶支管口的下限对齐。。
②为保证冷凝效果,冷凝管中的水流方向错误。正确做法应是上进下出,。
③为防止炸裂烧杯,烧杯不能直接加热。正确做法应该垫上石棉网,。
(4)① C → B → D →A→G→ H →E→F(2分)
②与大气相通,使液体顺利流下(2分)
③苯与水互不相溶且不反应;I2在苯中溶解度比在水中的大;苯与碘互不反应
考点:从海带中提取碘的有关知识。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
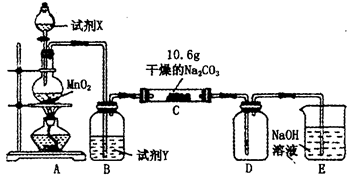
同步拓展阅读系列答案Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与干燥Na2CO3 固体反应得到的固体物质的成分。
已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中固体含有NaHCO3 ,且含氯的盐只有一种。现对C的成分进行猜想和探究。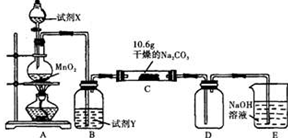
(1)提出合理猜想:若已知C中有0.1molCl2恰好和10.6克Na2CO3固体完全反应。则C中有Cl2参与反应的化学方程式可能 。
(2)①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
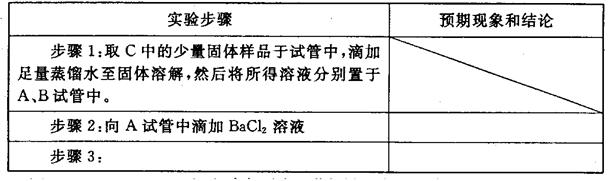
②设计合理方案对C固体中的未知成分进行探究。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、Ba(OH)2溶液、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中。 | |
| 步骤2: | |
| 步骤3: | |
| | |
①现有烧杯、玻璃棒、量筒、胶头滴管,要配制0.0150 mol/L K2Cr2O7溶液100mL,还需要的玻璃仪器是 。
②取25mL待测液进行滴定,平均消耗 K2Cr2O7溶液体积为25.00 mL,则铁矿石中铁元素的百分含量是(Fe的相对原子质量为56) 。
③在本实验的滴定过程中,下列操作会使测定结果偏小的是 (填写序号)。
a.未用标准K2Cr2O7溶液润洗滴定管
b.锥形瓶中加入待测溶液后,再加少量水
c.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
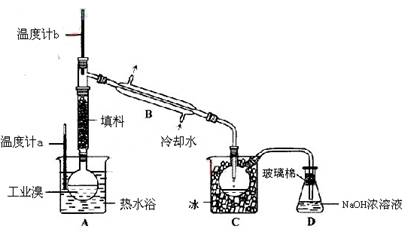
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_______气体。继续滴加至液溴滴完。装置d的作用是_____ ___;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必需的是________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________ (填入正确选项前的字母)。
A. 25 mL B.50 mL C.250 mL D.500 mL
某化学兴趣小组的同学通过以下步骤提取海带中的碘:
①将海带晒干灼烧成灰 ②将海带灰浸泡得其悬浊液 ③过滤得含碘离子的溶液 ④向该溶液中加入适量Cl2置换出碘 ⑤对含碘溶液进行一系列的提取后得碘单质
(1)灼烧过程可在下列那种仪器中进行_____________
| A.烧杯 | B.试管 | C.蒸发皿 | D.坩埚 |
(3)用有机溶剂将碘从水中提取出来需用到下列哪套装置

(4)若用四氯化碳作溶剂进行提取,则分层后下层物质为
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 。
猜测2:白色不溶物可能为MgCO3。
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验I中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___?___ |
| 实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量 ? | ? | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④ 离子 |

称取实验Ⅰ中所得干燥、纯净的白色不溶物22.6 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重8.8 g,试确定白色不溶物的化学式 。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因_________。