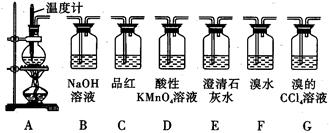
题目内容
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下: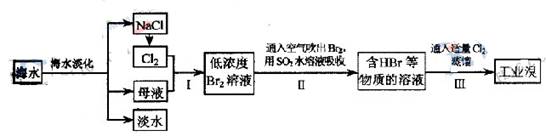
(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为 。
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(3)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图: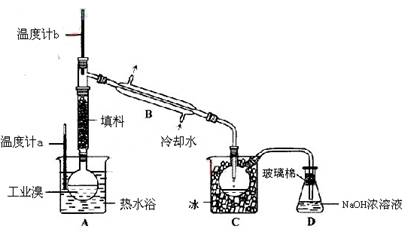
请你参与分析讨论:
①图中仪器B的名称 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
(1)富集溴元素
(2)Br2+SO2+2H2O=4H++SO42-+2Br-
强酸对设备的严重腐蚀
(3)①冷凝管
②Br2腐蚀橡胶
③控制温度计b的温度,并收集59℃时的馏分
④深红棕色 分液(或蒸馏)
解析试题分析:(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴,所以目的是用于富集溴元素。
(2)二氧化硫被溴单质氧化,所以离子方程式为:Br2+SO2+2H2O═4H++SO42-+2Br-,工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备。
(3)①图中仪器B为冷凝管。
②溴具有腐蚀性,可以腐蚀橡胶。
③蒸馏的目的,就是通过沸点不同而提纯Br2,根据Br2的沸点为59℃,所以要通过温度计b测量气体的温度,收集59℃时的馏分。
④C中收集的为液溴,颜色为深红棕色;利用Cl2与Br2溶解性的不同,可用分液法分离,利用Cl2与Br2沸点不同,可用蒸馏法分离。
考点:本题考查工业流程的分析、离子方程式的书写、混合物的分离。

 阅读快车系列答案
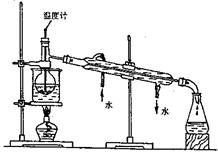
阅读快车系列答案半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl,遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,E中冷水的作用是 ,F中碱石灰的作用是 。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通入干燥CO2的作用是 。通过控制K1、K2能除去A、B装置中的空气,具体的方法是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为 ,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~ 。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加 溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的 。


 CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个):
CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个):