题目内容
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g)![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g)![]() C(s)+CO2(g) △H=-17kJ/mol
C(s)+CO2(g) △H=-17kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
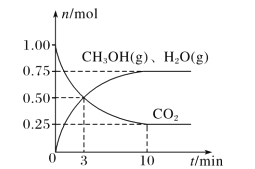
①从反应开始到平衡,氢气的平均反应速率v(H2)= ____。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
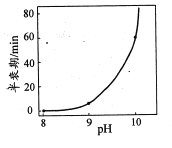
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
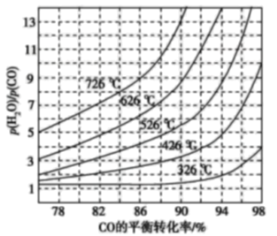
①上述反应的正反应方向是 ____(填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是 _______,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
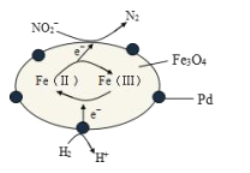
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是 ____(填字母)。
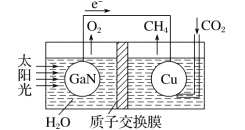
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
【答案】![]()
![]() ACD 放热 相等 不变 投料比太低,
ACD 放热 相等 不变 投料比太低,![]() 的转化率不高,而投料比3~5时转化率已经在97%左右,再增加投料比收益不明显,经济上不划算,而反应温度是根据催化剂的活性温度来制定的 BCD
的转化率不高,而投料比3~5时转化率已经在97%左右,再增加投料比收益不明显,经济上不划算,而反应温度是根据催化剂的活性温度来制定的 BCD
【解析】
(1)该小题是一道典型的盖斯定律的应用,通过观察可以发现用③-2![]() ①+②即可得到目标方程,注意各物质的状态不要漏标;
①+②即可得到目标方程,注意各物质的状态不要漏标;
(2)①先写出反应方程式![]() ,化学反应速率之比等于化学计量数之比,因此只要算出任意一种物质的速率,即可得到氢气的反应速率;
,化学反应速率之比等于化学计量数之比,因此只要算出任意一种物质的速率,即可得到氢气的反应速率;
②转化率即某一反应物的转化百分率,可以用物质的量、质量、体积(相同条件下)来计算,据此来分析各选项即可;
(3)根据题图,当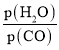 相同时,温度越高转化率越低,因此正反应是放热反应;
相同时,温度越高转化率越低,因此正反应是放热反应;
(4)虽然题干里告诉我们这是一个“人工光合系统”,实际上因为该装置无外电源,因此必然为一个原电池装置,再来根据原电池的规律分析即可。
(1)根据盖斯定律,由③-2![]() ①+②得到
①+②得到![]() ,
,![]() ;
;
(2)①该反应为:CO2(g)+3H2(g) ![]() H2O(g)+CH3OH(l);先求出
H2O(g)+CH3OH(l);先求出![]() 的平均反应速率:
的平均反应速率:![]() ,则氢气的平均反应速率为
,则氢气的平均反应速率为![]() 的三倍,即
的三倍,即![]() ;
;
②A.向原容器中充入更多的![]() 一定会导致
一定会导致![]() 的转化率降低,A项正确;
的转化率降低,A项正确;
B.向原容器中充入氢气(另一种反应物),则可以提高![]() 的转化率,B项错误;
的转化率,B项错误;
C.容器是定容的,充入氦气后容器体积不改变,各物质的浓度不改变,因此平衡也不会改变,平衡转化率自然也不会改变,C项正确;
D.催化剂不改变平衡,自然无法影响转化率,D项正确;
E.缩小容器体积相当于增大压强,根据勒夏特列原理,平衡向气体分子数减少的方向移动(正向),则![]() 转化率增大,E项错误;
转化率增大,E项错误;
F.将水蒸气(产物)从体系中分离,可以使逆反应速率小于正反应速率,平衡也会正向移动,![]() 转化率增大,F项错误;
转化率增大,F项错误;
答案选ACD;
(3)①当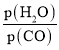 相同时,温度越高转化率越低,因此正反应是放热反应;
相同时,温度越高转化率越低,因此正反应是放热反应;
②既然我们用某组分的平衡压强来代替物质的量浓度,则![]() ,而平衡压强与浓度成正比,因此可以说明
,而平衡压强与浓度成正比,因此可以说明![]() ;对于给定的反应,平衡常数大小只与温度有关,因此改变
;对于给定的反应,平衡常数大小只与温度有关,因此改变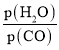 不会影响
不会影响![]() ;根据图表我们发现若投料比太低,
;根据图表我们发现若投料比太低,![]() 的转化率不高,而投料比3~5时转化率已经在97%左右,再增加投料比收益不明显,在经济上不划算,而反应温度是根据催化剂的活性温度来制定的,该温度下催化剂活性最大;
的转化率不高,而投料比3~5时转化率已经在97%左右,再增加投料比收益不明显,在经济上不划算,而反应温度是根据催化剂的活性温度来制定的,该温度下催化剂活性最大;
(4)A.根据分析这是一个原电池装置,将太阳能转化为电能和化学能,A项错误;
B.原电池中,电子从负极流出,经外电路流回正极,因此铜为正极,![]() 在正极得电子转变为甲烷,B项正确;
在正极得电子转变为甲烷,B项正确;
C.原电池工作时,阳离子从负极流向正极,C项正确;
D.负极发生水的光解![]() ,因此电池的总反应方程为
,因此电池的总反应方程为![]() ,因此理论上溶液pH不变,D项正确;
,因此理论上溶液pH不变,D项正确;
答案选BCD。

【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
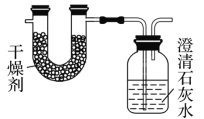
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的二氧化碳中碳元素的质量为________g。
(3)该燃料中碳元素与氢元素的质量比为________。
(4)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________________。