题目内容
【题目】NaBH4是一种常见的还原剂。一种以H2、Na、硼酸三甲酯[B(OCH3)3]为原料,生产NaBH4的工艺流程如下:
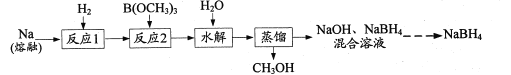
(1)下列措施能提高“反应1”的化学反应速率的有______(填字母)。
A.充分搅拌熔融钠
B.将熔融钠充分分散在石蜡油中
C.反应前排尽装置中的空气
(2)在浓硫酸作用下,B(OCH3)3可由B(OH)3和CH3OH发生酯化反应制得。浓H2SO4的作用是_____。
(3)“反应2”在240℃条件下进行,生成的产物是NaBH4和CH3ONa,写出该反应的化学方程式:____ 。“反应2”所用B(OCH3)3需充分干燥,原因是______。
(4)反应NaBH4+2H2O=NaBO2+4H2 可用于制取H2。一定浓度的NaBH4催化制氢的半衰期(溶液中NaBH4消耗一半时所需的时间)与溶液pH的关系如图所示:

①NaBH4与水反应所得溶液呈碱性,原因是____。
②随着反应的进行,生成H2的速率逐渐减慢,原因是_______。
【答案】AB 催化剂、吸水剂 ![]() 防止NaH与水发生反应 NaBO2水解,使溶液呈碱性 反应物的浓度逐渐减小,溶液的碱性逐渐增大
防止NaH与水发生反应 NaBO2水解,使溶液呈碱性 反应物的浓度逐渐减小,溶液的碱性逐渐增大
【解析】
由工艺流程可知,Na和H2反应生成NaH,NaH和![]() 反应生成
反应生成![]() 和
和![]() ,
,![]() 水解得到NaOH和
水解得到NaOH和![]() ,蒸馏分离
,蒸馏分离![]() ,以此分析。
,以此分析。
(1)提高化学反应速率的方法有增加反应物浓度,升高温度,增加接触面积等,
A.充分搅拌熔融钠,增大接触面积,可以提高化学反应速率,故A正确;
B.将熔融钠充分分散在石蜡油中,增大接触面积,可以提高化学反应速率,故B确;
C. 反应前排尽装置中的空气,防止氢气不存发生爆炸,与化学反应速率无关,故C错误;
故答案选:AB。
(2)浓硫酸在反应中起到催化剂的作用,还能吸收生成的水分,使平衡正移;
故答案为:催化剂、吸水剂
(3)NaH和![]() 在240℃反应生成
在240℃反应生成![]() 和
和![]() ,则化学方程式为:
,则化学方程式为:![]() ,NaH易与水反应,因此为防止NaH与水发生反应“反应2”所用B(OCH3)3需充分干燥;
,NaH易与水反应,因此为防止NaH与水发生反应“反应2”所用B(OCH3)3需充分干燥;
故答案为:![]() ;防止NaH与水发生反应;
;防止NaH与水发生反应;
(4)HBO2为弱酸NaBO2水解呈碱性,NaBH4与水反应生成NaBO2溶液呈碱性,
故答案为:NaBO2水解,使溶液呈碱性;
(5)由图像可知pH越大,半衰期越长,则反应越慢,随着反应的进行,反应物浓度减小,反应速率降低,
故答案为:反应物的浓度逐渐减小,溶液的碱性逐渐增大。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
【题目】Ⅰ、实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2 -二溴乙烷。在制备过程中部分乙醇被浓硫酸氧化,产生CO2、SO2,并进而与溴反应生成HBr等酸性气体。
(1)用下列仪器,以上述三种物质为原料制备1,2一二溴乙烷。如果气体流向为从左到右,正确的连接顺序是(短接口或橡皮管均已略去):B经A①插人A中,D接A②;A③接_______接_____接_____接______。
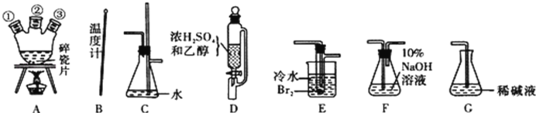
(2)装置C的作用是________________;
(3)在反应管E中进行的主要反应的化学方程式为____________________;
Ⅱ、某兴趣小组同学在实验室用加热l-丁醇、浓H2SO4和溴化钠混合物的方法来制备1-溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出)。
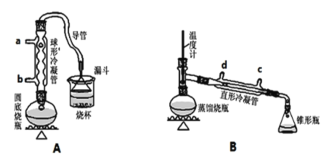
请回答下列问题:
(1)两个装置中都用到了冷凝管,A装置中冷水从_________(填字母代号)进入,B装置中冷水从________(填字母代号)进入。
(2)制备操作中,加入的浓硫酸事先稍须进行稀释,其目的是________。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)为了进一步提纯1-溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至_________收集所得馏分。
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)。请评价该同学设计的鉴定方案是否合理?________为什么?答:________。