题目内容
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并使产生的气体全部通过如图所示装置中,得到如表中所列的实验结果(假设产生的气体完全被吸收)。
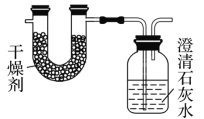
实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1 g | 102.9 g |
(石灰水+广口瓶)的质量 | 312.0 g | 314.2 g |
根据实验数据完成下列问题:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的二氧化碳中碳元素的质量为________g。
(3)该燃料中碳元素与氢元素的质量比为________。
(4)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________________。
【答案】1.8 5 0.6 3∶1 CH4O CH3OH
【解析】
已知某醇燃料含有碳、氢、氧三种元素,故其完全燃烧产物为CO2和H2O,U型管中增加的质量是水的质量,NaOH溶液中增加的质量是二氧化碳的质量,根据C、H元素守恒,即可计算两者的质量比,该燃料分子中C、H的原子个数比为,N(C):N(H)=![]() ∶
∶![]() = 1:4。据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1∶4时,分子中只能含CH4,而不能为CH4的整数倍。
= 1:4。据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1∶4时,分子中只能含CH4,而不能为CH4的整数倍。
⑴U型管中增加的水的质量m(H2O)=102.9g101.1g=1.8g;NaOH溶液中增加的二氧化碳的质量m(CO2)=314.2g312g=2.2g,CO2 + Ca(OH)2 = CaCO3↓+ H2O,得到碳酸钙沉淀质量![]() ;故答案为:1.8;5。
;故答案为:1.8;5。
⑵m(C)=m(CO2)×![]() =2.2g×
=2.2g×![]() =0.6g,故生成的二氧化碳中碳元素的质量为0.6g;故答案为:0.6。
=0.6g,故生成的二氧化碳中碳元素的质量为0.6g;故答案为:0.6。
⑶m(H)=m(H2O)×![]() =1.8g×
=1.8g×![]() =0.2g,故生成的水中氢元素的质量为0.2g;m(C):m(H)=0.6g:0.2g=3:1,故该燃料中碳元素与氢元素的质量比为3:1;故答案为:3:1。
=0.2g,故生成的水中氢元素的质量为0.2g;m(C):m(H)=0.6g:0.2g=3:1,故该燃料中碳元素与氢元素的质量比为3:1;故答案为:3:1。
⑷该燃料分子中C、H的原子个数比为N(C):N(H)= ![]() ∶
∶![]() =1:4,据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1:4时,分子中只能含CH4,而不能为CH4的整数倍,又因为每个分子中含有一个氧原子,则该物质的分子式为CH4O,结构简式为CH3OH;故答案为:CH4O;CH3OH。
=1:4,据碳四价的原则可知,当有机物分子中的碳氢原子个数比为1:4时,分子中只能含CH4,而不能为CH4的整数倍,又因为每个分子中含有一个氧原子,则该物质的分子式为CH4O,结构简式为CH3OH;故答案为:CH4O;CH3OH。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案