题目内容
【题目】硫酸铝铵[Ala(NH4)b(SO4)c.xH2O]又叫做明矾、宝石明矾,其相对分子质量为906,常用作净水剂和制造人工刚玉(γ-Al2O3)
(1)[Ala(NH4)b(SO4)c.xH2O]中a、b、c的代数关系式是_________。
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体的分子式是_______。
(3)为确定硫酸铝铵的组成,进行如下实验:
①明确称取4.530g样品与足量氯化钡溶液充分反应,生成白色沉淀4.660g
②另取4.530g样品在空气中加热,样品的固体残留率(![]() ×100%)随温度的变化如图所示:
×100%)随温度的变化如图所示:
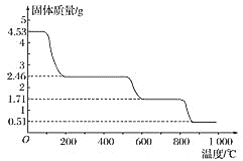
根据以上实验数据计算硫酸铝铵的分子式_____。
【答案】3a+b=2c SO3 Al2(NH4)2(SO4)4·24H2O
【解析】
(1)依据元素化合价代数和计算分析a、b、c的代数关系式;
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体,根据反应前后元素化合价不变,可知硫酸盐分解生成金属氧化物和三氧化硫;
(3)先计算硫酸铝铵晶体物质的量,反应后的沉淀为硫酸钡,计算物质的量得到硫酸根离子物质的量,依据图象分析计算氧化铝物质的量,结合化合价代数和为0计算得到b,依据相对分子质量计算x,据此确定化学式。
(1)[Ala(NH4)b(SO4)c.xH2O]中的Ala(NH4)b(SO4)c元素化合价代数和为0得到: 3a+b+(-2c)=0,a、b、c的代数关系式为:3a+b=2c;
(2)硫酸铝铵受热最终分解为Al2O3、H2O、NH3和另外一种气体,根据反应前后元素化合价不变,可知硫酸盐分解生成金属氧化物和三氧化硫,所以另一种气体是硫元素化合价为+6价的SO3;
(3)4.53g硫酸铝铵晶体的物质的量n[Ala(NH4)b(SO4)c.xH2O]=![]() =0.005mol,n(SO42-)=
=0.005mol,n(SO42-)=![]() =0.02mol,c=
=0.02mol,c=![]() =4,加热到最后得到固体为Al2O3,氧化铝的含量为:
=4,加热到最后得到固体为Al2O3,氧化铝的含量为:![]() ×100%=11.26%,n(Al2O3)=
×100%=11.26%,n(Al2O3)=![]() =0.005 mol,a=
=0.005 mol,a=![]() =2,根据电荷守恒3a+b=2c,b=2×4-3×2=2,根据物质相对分子质量为906可知x=
=2,根据电荷守恒3a+b=2c,b=2×4-3×2=2,根据物质相对分子质量为906可知x=![]() =24,故硫酸铝铵的分子式:Al2(NH4)2(SO4)4·24H2O。
=24,故硫酸铝铵的分子式:Al2(NH4)2(SO4)4·24H2O。

【题目】铝粉和氧化铁粉末的混合物制成的铝热剂可用于焊接钢轨。现取不同质量的该铝热剂分别和100ml同物质的量浓度的NaOH溶液反应,所取铝热剂的质量与产生气体的体积关系如下表(气体体积均在标准状况下测定):
① | ② | ③ | ④ | |
铝热剂质量/g | 5g | 10g | 15g | 20g |
气体体积/L | 2.24L | 4.48L | 6.72L | 6.72L |
试完成下列计算:
(1)NaOH溶液的物质的量浓度_______________。
(2)该铝热剂中铝的质量分数_____________
(3)20g该铝热剂发生铝热反应理论上产生铁的质量是多少?________(写出步骤)