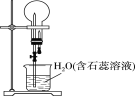
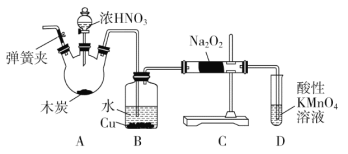
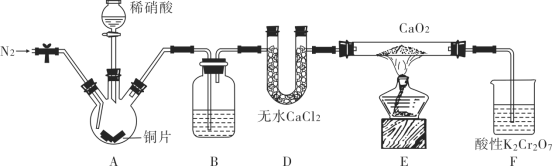
题目内容
【题目】氯碱厂电解饱和食盐水制取的工艺流程图如下:

(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________,与电源负极相连的电极上所发生反应的电极反应式为__________________。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________。
(3)如果粗盐中![]() 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去![]() ,该钡试剂可以是______(填字母)。
,该钡试剂可以是______(填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、![]() ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、结晶、________(填写操作名称)除去NaCl。
【答案】2Cl--2e-=Cl2↑ 2H++2e-=H2↑ Ca2++![]() =CaCO3↓、Mg2++2OH-=Mg(OH)2↓ ac bc 蒸发 过滤
=CaCO3↓、Mg2++2OH-=Mg(OH)2↓ ac bc 蒸发 过滤
【解析】
(1)电解饱和食盐水中,与电源正极相连的是阳极,阳极发生氧化反应;与电源负极相连的是阴极,发生还原反应;
(2)碳酸钠与钙离子反应生成碳酸钙沉淀,氢氧化钠与镁离子反应生成氢氧化镁沉淀;
(3)硫酸根离子可用钡离子除去,但不能选择硝酸钡,因为会引入NO3-;
(4)钙离子用碳酸钠除去,过量的碳酸根离子用盐酸除去,且硫酸根所用的钡试剂是过量的,而过量的钡离子也用碳酸钠除去,所以只要最后加入碳酸钠即可;
(5)根据氢氧化钠与氯化钠溶解度的不同,将溶液蒸发,冷却,析出的氯化钠过滤除去。
(1)电解饱和食盐水中,与电源正极相连的电极为电解池的是阳极,阳极发生氧化反应,所以是氯离子失去电子生成氯气,电极反应式为2Cl--2e-=Cl2↑;与电源负极相连的电极为电解池的阴极,阴极发生还原反应,所以水电离产生的氢离子得到电子生成氢气,电极反应式为2H++2e-=H2↑,故答案为2Cl--2e-=Cl2↑,2H++2e-=H2↑。
(2)工业盐中的钙、镁离子用碳酸钠、氢氧化钠溶液除去,碳酸钠与钙离子反应生成碳酸钙沉淀,氢氧化钠与镁离子反应生成氢氧化镁沉淀,离子方程式为Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓。
(3)硫酸根离子用钡试剂除去,可选择氢氧化钡或氯化钡溶液,不能选择硝酸钡溶液,因为过量的钡离子可用碳酸钠除去,碳酸根离子、氢氧根离子再用盐酸除去,而硝酸钡中的硝酸根离子无法除去,造成食盐不纯;故答案为:ac。
(4)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,所以可先加NaOH,后加钡试剂,再加Na2CO3,也可以先加钡试剂,后加Na2CO3,再加NaOH,所以bc正确,故答案为:bc。
(5)脱盐工序的目的是分离NaOH和NaCl,由于NaCl溶解度小,因而NaCl首先析出,其操作过程是蒸发、冷却、结晶、过滤得到NaCl晶体,故答案为:蒸发,过滤。

【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
【题目】为了测定黄铜(铜、锌合金)中铜的质量分数,取20g黄铜样品加入大烧杯中,把200g稀盐酸分四次加入,实验所得数据如下表:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸质量/g | 50 | 50 | 50 | 50 |
剩余固体的质量/g | 16.75 | 13.5 | m | 12.2 |
计算:
(1)表中m=______。
(2)黄铜样品中铜的质量分数为多少?(写出计算过程)______
(3)反应总共产生气体的物质的量是多少?(写出计算过程)_______
【题目】某实验探究小组研究320 K时N2O5的分解反应:2N2O5![]() 4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是
4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是
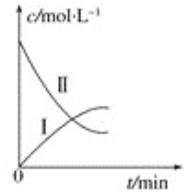
t/min | 0 | 1 | 2 | 3 | 4 |
c(N2O5)/mol/L | 0.160 | 0.114 | 0.080 | 0.056 | 0.040 |
c(O2)/mol/L | 0 | 0.023 | 0.040 | 0.052 | 0.060 |
A.曲线Ⅰ是N2O5的浓度变化曲线
B.曲线Ⅱ是O2的浓度变化曲线
C.N2O5的浓度越大,反应速率越快
D.升高温度对该反应速率无影响