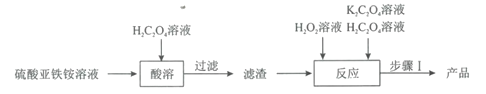
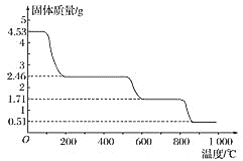
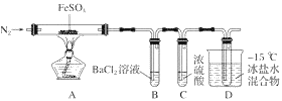
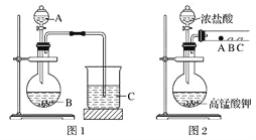
题目内容
【题目】阿伏伽德罗常数的值为NA。下列说法正确的是
A.18 g H2O、D2O组成的物质中含有的电子数为10NA
B.0.2 mol铁在足量的氧气中燃烧,转移电子数为0.6NA
C.50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.0.1 mol 熔融的KHSO4中含有0.1NA个阳离子
【答案】D
【解析】
A. H2O、D2O分子中都含有10个电子,H2O相对分子质量是18,而D2O的相对分子质量为20,所以18 g两种分子构成的物质的物质的量小于1 mol,含有的电子数目小于10NA,A错误;
B. 铁在足量的氧气中燃烧生成Fe3O4,3 mol Fe反应转移8 mol电子,则0.2 mol Fe反应转移电子的物质的量为![]() ×8NA=0.53NA,B错误;
×8NA=0.53NA,B错误;
C. 浓盐酸与MnO2混合加热反应产生Cl2,每有4 mol HCl反应,转移2 mol电子,在该溶液中含HCl的物质的量 n(HCl)=cV=12 mol/L×0.05 L=0.6 mol,若盐酸中HCl完全反应,转移电子的物质的量为n(e-)=0.6 mol×![]() =0.3 mol,转移电子数目为0.3NA,但随着反应的进行浓盐酸会转变为稀盐酸,反应不再进行,因此转移电子数目小于0.3NA,C错误;
=0.3 mol,转移电子数目为0.3NA,但随着反应的进行浓盐酸会转变为稀盐酸,反应不再进行,因此转移电子数目小于0.3NA,C错误;
D. 0.1 mol熔融的KHSO4电离产生0.1 mol K+、0.1mol HSO4-,因此含有阳离子数目为0.1NA个,D正确;
故合理选项是D。

练习册系列答案
相关题目