题目内容
【题目】某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使___,灼烧后的坩埚应放在___上,不能直接放在桌面上。
a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___、冷却结晶、___、自然干燥。
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:____。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x值偏高,可能的原因是___。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
【答案】c e b ab 蒸发 过滤 产生等量胆矾途径Ⅱ消耗硫酸少;途径Ⅱ不会产生污染大气的气体 a
【解析】
(1)根据固体加热分析,用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却;
(2)根据氧化铜和铜的性质分析,铜在加热条件下易生成氧化铜,氧化铜稳定,难以分解;
(3)由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体;
(4)途径Ⅰ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体;
(5)a.加热温度过高,会导致硫酸铜分解,质量变化较大;
b.胆矾晶体的颗粒较大,会导致晶体解热分解不完全,质量变化偏小,结果偏小;
c.加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小;
d.胆矾晶体部分风化,会使水的含量较小,结果偏小. 在灼烧过程中铜可被空气氧化;
(1)用坩埚加热固体时应将坩埚放在泥三角上加热,加热时用坩埚钳夹持坩埚,加热后放在石棉网上冷却,
故答案为:c;e;b;
(2) 在灼烧过程中铜可被空气氧化,但生成的氧化铜也可被有机物还原,铜在加热条件下易生成氧化铜,氧化铜稳定,难以分解, a、b项正确,
故答案为:ab;
(3)由硫酸铜溶液制得硫酸铜晶体,经过滤后加热蒸发硫酸铜溶液,冷却结晶后、过滤、干燥后可得纯净的硫酸铜晶体,
故答案为:蒸发;过滤;
(4)途径Ⅰ有浓硫酸参加反应,消耗较多硫酸,并产生污染性二氧化硫气体,
故答案为:产生等量胆矾途径Ⅱ消耗硫酸少;途径Ⅱ不会产生污染大气的气体;
(5)a.加热温度过高,会导致硫酸铜分解,质量变化较大,导致结果偏大,故a符合题意;
b.胆矾晶体的颗粒较大,会导致晶体受热分解不完全,质量变化偏小,结果偏小,故b不符合题意;
c.加热后放在空气中冷却,会吸收空气中的水重新形成晶体,结果偏小,故c不符合题意;
d.胆矾晶体部分风化,会使水的含量较小,结果偏小,故d不符合题意;
故答案选a。

【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。
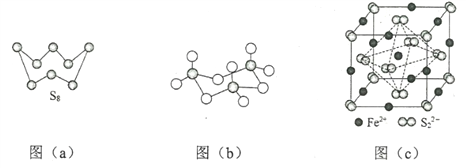
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。