题目内容
【题目】今有甲、乙、丙三瓶等体积的新制的氯水,浓度均为0.1molL-1。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量NaHSO3(mmol),丙瓶不变,片刻后甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙B.甲>乙>丙C.丙>甲=乙D.甲>丙>乙
【答案】D
【解析】
①甲中加入少量的NaHCO3晶体:HClO的酸性比碳酸弱但比![]() 的酸性强,加入少量的NaHCO3晶体和HCl反应,可促进氯气与水的反应
的酸性强,加入少量的NaHCO3晶体和HCl反应,可促进氯气与水的反应![]() 正向移动,生成更多的HClO;
正向移动,生成更多的HClO;
②乙中加入少量的NaHSO3晶体:HClO可与NaHSO3发生氧化还原反应而导致HClO浓度降低;
③丙不变;
则甲、乙、丙三瓶溶液中HClO的物质的量浓度的大小关系为甲>丙>乙;答案选D。

 轻巧夺冠周测月考直通名校系列答案
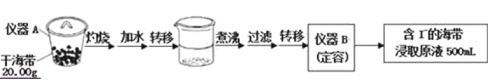
轻巧夺冠周测月考直通名校系列答案【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
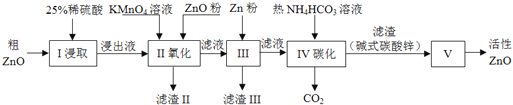
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯外,还需要_______(选填编号)
A.电子天平 B.量筒 C.容量瓶 D.胶头滴管
(2)步骤II中通过加入KMnO4氧化,并用ZnO调节pH,可以除去含铁杂质.检验沉淀是否完全的实验操作是_________.调节pH的适宜范围是_________.
(3)步骤III中加入Zn粉的作用是:①________;②进一步调节溶液pH.
(4)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是________.
(5)步骤V在_______(填仪器名称)中进行,已知碱式碳酸锌的化学式为Zn5(OH)6(CO3)2,请写出发生反应的化学方程式:________.判断已分解完全的操作是________.
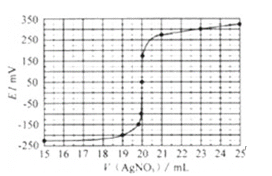
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
假设杂质不参与反应,则所得活性氧化锌的纯度为_______.若在滴定时,实际操作中过量半滴(1mL溶液为25滴),则本次滴定的相对误差为_____.
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
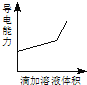
A.AB.BC.CD.D