题目内容
【题目】含硫化合物在生产生活中有广泛应用,其吸收处理也十分重要。
(1)完成并配平下列离子方程式_____。
Fe3++ SO2+ → Fe2++ SO42-+
(2)标明电子转移的方向和数目______: Fe3++ SO2……。
(3)在Na2SO3溶液中滴加酚酞,溶液呈红色,若在该溶液中滴入过量的BaCl2溶液,实验现象为:_____。请结合离子方程式,运用平衡原理进行解释_____。
(4)在NaClO溶液中通入SO2,写出反应的离子方程式:_____。
(5)在0.1mol/LNa2SO3溶液中,下列关系式正确的是_____。
a.[Na+]+[H+]=[SO32-]+[HSO3-]+[OH-] b.[Na+]>[SO32-]>[OH-]>[H+]
c.[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3] d.[Na+]=2[SO32-]>[OH-]=[H+]
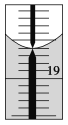
(6)向该溶液中加入少量Na2SO3固体,![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
【答案】2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 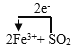 产生白色沉淀,且红色褪去 在Na2SO3溶液中,SO32-水解SO32-+H2OHSO3-+OH-,加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,酚酞褪色 ClO-+SO2+H2O=Cl-+SO42-+2H+ bc 减小
产生白色沉淀,且红色褪去 在Na2SO3溶液中,SO32-水解SO32-+H2OHSO3-+OH-,加入BaCl2后,Ba2++SO32-=BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,酚酞褪色 ClO-+SO2+H2O=Cl-+SO42-+2H+ bc 减小
【解析】
(1)![]() 失去一个电子,
失去一个电子,![]() ,得到两个电子,为了得失电子守恒:2×Fe3++ SO2+ ( ) =2×Fe2++SO42-+ ( ) ,左侧正电荷数少4个,用4H+补充电荷,用2H2O补H和O;
,得到两个电子,为了得失电子守恒:2×Fe3++ SO2+ ( ) =2×Fe2++SO42-+ ( ) ,左侧正电荷数少4个,用4H+补充电荷,用2H2O补H和O;
(2)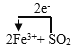
(3)Na2SO3溶液与BaCl2溶液反应生成BaSO3白色沉淀:Ba2++SO32-=BaSO3↓,使![]() 水解平衡
水解平衡![]() 逆向移动,c(OH)减小,所以酚酞褪色;
逆向移动,c(OH)减小,所以酚酞褪色;
(4)ClO有氧化性,能够氧化SO2变成![]() ,ClO变成Cl—,反应的离子方程式为:
,ClO变成Cl—,反应的离子方程式为:![]() ;
;
(5)a.电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),a错误;
b.![]() ,c(Na+)>c(SO32-),水解
,c(Na+)>c(SO32-),水解![]() 显碱性,而且水解程度低,有c(SO32-)>c(OH-)>c(H+),故c(Na+)>c(SO32-)>c(OH-)>c(H+),b正确;
显碱性,而且水解程度低,有c(SO32-)>c(OH-)>c(H+),故c(Na+)>c(SO32-)>c(OH-)>c(H+),b正确;
c.根据物料守恒:![]() ,则
,则![]() ,c正确;
,c正确;
d.![]() 发生水解:
发生水解:![]() ,所以c(Na+)>2c(SO32-),溶液显碱性,所以c(OH-)>c(H+),故c(Na+)>2c(SO32-)>c(OH-)>c(H+),d错误;
,所以c(Na+)>2c(SO32-),溶液显碱性,所以c(OH-)>c(H+),故c(Na+)>2c(SO32-)>c(OH-)>c(H+),d错误;
答案为:bc;/p>
(6)加入Na2SO3后,Na2SO3的浓度升高,![]() 的水解能力变弱,相当于
的水解能力变弱,相当于![]() 不变时,
不变时,![]() 升高,因此
升高,因此![]() 减小。
减小。