题目内容
【题目】阿伏伽德罗常数可用NA表示,下列叙述中正确的是( )
A.1mol H2O所含的原子数为NA个
B.16g O2-含有的电子数为10NA个
C.常温常压下,11.2L Cl2所含分子数为0.5NA个
D.1L 1mol/L NaClO溶液中含ClO-个数为NA个
【答案】B
【解析】
A.一个H2O有三个原子,那么按照比例1mol H2O含有3mol原子,即3NA个原子,A错误;
B.一个O2-含有10个电子,![]() ,因此1mol O2-含有10mol电子,即10NA个电子,B正确;
,因此1mol O2-含有10mol电子,即10NA个电子,B正确;
C.常温常压下,不能使用Vm=![]() 进行相关计算,C错误;
进行相关计算,C错误;
D.NaClO溶液中,部分ClO-水解生成HClO,所以ClO-数目小于NA个,D错误;
答案选B。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
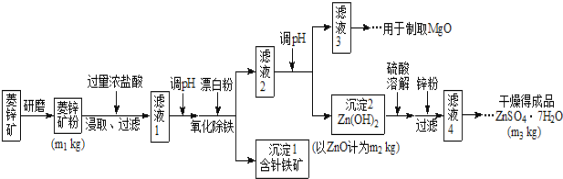
(1)将菱锌矿研磨成粉的目的是_______________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
工业上从“滤液3”制取MgO过程中,最合适的反应物是______________(选填序号)。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(4)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。