题目内容
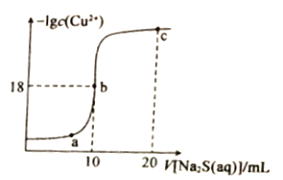
【题目】在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13。下列说法不正确的是( )

A.在t℃时,AgI的Ksp=2.5×10-15 mol2.L-2
B.图中b点有碘化银晶体析出
C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点
D.在t℃时,反应AgBr(s)+I-(aq)![]() AgI(s)+Br-(aq)的平衡常数K=200
AgI(s)+Br-(aq)的平衡常数K=200
【答案】C
【解析】
试题分析:A.结合图中c点的c(Ag+)和c(I-)可知:该温度下AgI的Ksp=5×10-8×5×10-8=2.5×10-15,A正确;B.根据图像可知,在b点时Qc=c(Ag+)c(I-)>Ksp,所以b点有AgI晶体析出,B正确;C.在AgI饱和溶液中加入适量蒸馏水,银离子和碘离子浓度均降低,因此不能使溶液由c点到a点,C错误;D.反应AgBr(s)+I-(aq)![]() AgI(s)+Br-(aq)的平衡常数为:K=c(Br)/c(I)=Ksp(AgBr)/Ksp(AgI)= 5×10-13/2.5×10-15 =200,D正确;答案选C。
AgI(s)+Br-(aq)的平衡常数为:K=c(Br)/c(I)=Ksp(AgBr)/Ksp(AgI)= 5×10-13/2.5×10-15 =200,D正确;答案选C。

【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。下列说法中,不正确的是
是三种常用的抗氧剂。下列说法中,不正确的是
已知:![]() 溶于水发生反应:
溶于水发生反应:![]()
实验用品 | 实验操作和现象 |
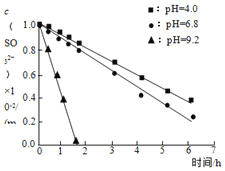
① ② ③ | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与 实验3:调溶液①②③的pH相同,保持体系中 |
A.![]() 溶液显碱性,原因是:
溶液显碱性,原因是:![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同