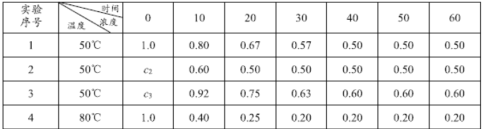
题目内容
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
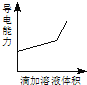
A.AB.BC.CD.D
【答案】BD
【解析】
A.浓度为0.1mol/L的盐酸,滴加同浓度的氢氧化钠溶液,生成氯化钠,溶液的体积变大,导致离子浓度减小,导电能力减弱,故A错误;
B.醋酸是弱电解质部分电离,向其中滴入氢氧化钠,生成的醋酸钠为强电解质,自由移动离子浓度增大,导电能力增强,故B正确;
C.氢氧化钠和氨水不反应,氨水是弱电解质,向氢氧化钠溶液中滴入氨水,相当于对氢氧化钠稀释,离子浓度减小,导电能力减弱,故C错误;
D.向氨水中滴入硝酸银,形成银铵络离子,先产生白色沉淀AgNO3+NH3H2O=AgOH+NH4NO3,继续滴加氨水,沉淀消失,发生AgOH+2NH3H2O=[Ag(NH3)2]OH +2H2O,而[Ag(NH3)2]OH是一元强碱,导致离子浓度增大,导电能力增强,故D正确;
选BD。

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案
相关题目