题目内容
18.短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族.A元素的最高正化合价和最低负化合价的绝对值之差为2;1mol C单质与冷水反应,在标准状况下生成11.2L H2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同.(1)用元素符号表示各元素AN、BF、CNa、DAl、ECl;
(2)能形成共价键的元素N、F、Cl、Al
(3)A的单质的电子式为

(4)C和B形成化合物的电子式
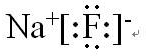
(5)写出C与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑.
分析 短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族.A元素的最高正化合价和最低负化合价的绝对值之差为2,可知最外层电子数为5,应为N元素;1mol C单质与冷水反应,在标准状况下生成11.2L H2,为Na元素,D原子最外层电子数等于其周期序数,为Al,E-的电子层结构与Ar原子相同,E为Cl元素,B和E同主族,则B为F元素,以此解答该题.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族.A元素的最高正化合价和最低负化合价的绝对值之差为2,可知最外层电子数为5,应为N元素;1mol C单质与冷水反应,在标准状况下生成11.2L H2,为Na元素,D原子最外层电子数等于其周期序数,为Al,E-的电子层结构与Ar原子相同,E为Cl元素,B和E同主族,则B为F元素,
(1)由以上分析可知A、B、C、D、E分别为N、F、Na、Al、Cl,故答案为:N、F、Na、Al、Cl;
(2)能形成共价键的为非金属元素,另外AlCl3为共价化合物,Al也能形成共价键,故答案为:N、F、Cl、Al;
(3)A为N元素,对应的单质氮气的电子式为 ,故答案为:
,故答案为: ;
;
(4)C和B形成化合物为NaF,为离子化合物,电子式为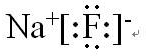 ,故答案为:
,故答案为: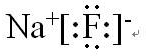 ;
;
(5)C为Na,性质活泼,可与水剧烈反应,生成氢氧化钠和氢气,反应的方程式为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题考查位置结构性质相互关系及应用,涉及离子方程式的书写、电子式的书写以及化学键等知识点,正确判断元素是解本题关键,注意离子方程式书写规则,为易错点.

练习册系列答案
相关题目
9.下列电子式正确的是( )
| A. | 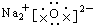 | B. | 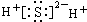 | ||
| C. | 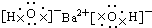 | D. |  |
13.19世纪中叶,门捷列夫的突出贡献是( )
| A. | 发现元素周期律 | B. | 提出分子学说 | C. | 提出原子学说 | D. | 提出电离学说 |
3.下列说法正确的是( )
| A. | 同周期ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第3周期元素的离子半径从左到右逐渐减小 |
10.关于化学反应中能量变化的说法错误的是( )
| A. | 如图所示的反应为吸热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热才有发生的反应一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
1.向BaCl2溶液中通入某混合气体,无沉淀产生,则该混合气体是( )
| A. | 2molNO和1molCO2 | B. | 1molCO2和2molNH3 | ||
| C. | 1molCl2和lmolSO2 | D. | 1molNO2和lmolSO2 |
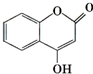 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: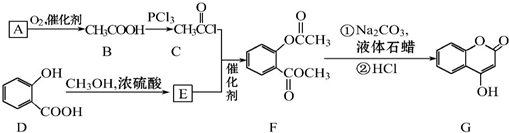
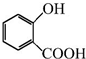 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$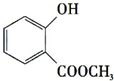 +H2O.
+H2O. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.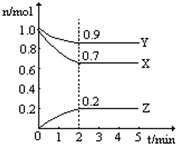 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: