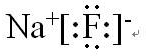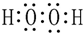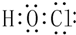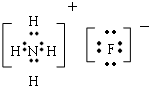题目内容
6.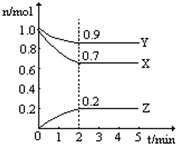 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:(1)该反应的化学方程式为:3X+Y?2Z
(2)反应开始至2min,用X表示的平均反应速率为:0.075mol/(L•min);
平衡时,X的转化率为30%;平衡时,Y的浓度为0.45 mol/L.
(3)下列叙述能说明上述反应达到化学平衡状态的是AD
A.混合气体的总物质的量不随时间的变化而变化
B.相同时间内每消耗3n mol的X的同时生成2n mol的Z
C.混合气体的总质量不随时间的变化而变化
D.容器内压强不再发生变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+Y (g)?2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
①降低温度:减小
②保持容器的体积不变,增加X(g)的物质的量:增大
③增大容器的体积:减小.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=$\frac{△c}{△t}$计算反应速率;X的转化率=$\frac{消耗量}{起始量}×100%$;Y的浓度c=$\frac{n}{V}$;
(3)反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,由此进行判断;
(4)根据外界条件对化学反应速率的影响因素可知,升高温度、增大压强、使用催化剂等都可以使反应速率增大,反之则减小反应速率,据此判断.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.1mol:0.3mol:0.2mol=1:3:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)X的起始量为1.0mol,平衡量为0.7mol,变化量为0.3mol;Y的平衡量为0.9mol,
v(X)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol•(L•min)-1,0.075mol•(L•min)-1,
X的转化率=$\frac{0.3mol}{1.0mol}$×100%=30%,
Y的浓度c=$\frac{n}{V}$=$\frac{0.9mol}{2L}$=0.45mol/L,
故答案为:0.075mol/(L. min);30%;0.45 mol/L;
(3)A、反应3X+Y?2Z为气体体积改变的反应,混合气体的总物质的量可判断达到平衡状态,故A正确;
B、相同时间内每消耗3n mol的X的同时生成2n mol的Z,表示的都是正反应速率,无法判断正逆反应速率相等,故无法判断是否达到平衡状态,故B错误;
C、反应前后气体的质量始终不变,故无法判断是否达到平衡状态,故C错误;
D、反应3X+Y?2Z为气体体积改变的反应,容器内压强不再发生变化表明达到平衡状态,故D正确,
故答案为:AD;
(4)根据外界条件对化学反应速率的影响因素可知,升高温度、增大压强、使用催化剂等都可以使反应速率增大,反之则减小反应速率,所以①降低温度则减小反应速率,②保持容器的体积不变,增加X(g)的物质的量增大反应速率,③增大容器的体积相当于减小压强,即减小反应速率,
故答案为:减小;增大;减小.
点评 本题考查物质的量随时间的变化曲线、以及平衡状态的判断、影响反应速率的因素,题目难度不大,注意平衡状态的判断角度

| A. | 离子化合物中可能含共价键 | B. | 碱和铵盐都是离子化合物 | ||
| C. | 离子化合物中不一定含金属元素 | D. | 离子化合物中一定含离子键 |
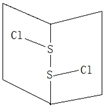 S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )| A. | 与S2Br2结构相似,熔沸点S2Br2>S2Cl2 | |
| B. | 分子中既含有极性键又含有非极性键 | |
| C. | 与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| D. | 为非极性分子 |
| A. | Cl原子结构示意图: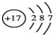 | B. | H2O2的电子式: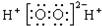 | ||
| C. | HClO的结构式H-O-Cl | D. | 14C的原子结构示意图: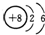 |
①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
| A. | 只有①⑤ | B. | ①②③④的混合物 | C. | 只有②⑤ | D. | ①②③④⑤的混合物 |
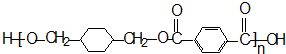
 -CH3+Cl2→
-CH3+Cl2→ -CH2Cl+HCl
-CH2Cl+HCl
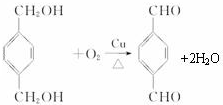
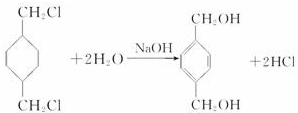
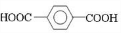 +
+ $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$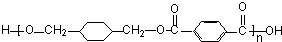 +(2n-1)H2O.
+(2n-1)H2O.