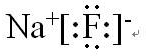题目内容
9.下列电子式正确的是( )| A. | 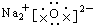 | B. | 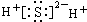 | ||
| C. |  | D. |  |
分析 A、氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
B、硫化氢为共价化合物,分子中存在2个氢硫共用电子对,硫原子最外层一个为8个电子;
C、氢氧化钡为离子化合物;
D、氮气分子中存在氮氮三键,应该存在3对共用电子对.
解答 解:A、氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: ,故A错误;
,故A错误;
B、H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故B错误;
,故B错误;
C、Ba(OH)2是离子化合物,由Ba2+离子和OH-离子构成,Ba(OH)2的电子式为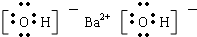 ,故C正确;
,故C正确;
D、氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气正确的电子式为 ,故D错误,故选C.
,故D错误,故选C.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
相关题目
4.下列各组中互为同位素的是( )
| A. | D2O和H2O | B. | 235U和238U | C. | 红磷和白磷 | D. | SO2和SO3 |
14.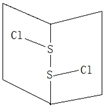 S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
 S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )
S2Cl2是橙黄色液体.少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液.其分子结构如图所示.下列关于S2Cl2的说法错误的是( )| A. | 与S2Br2结构相似,熔沸点S2Br2>S2Cl2 | |
| B. | 分子中既含有极性键又含有非极性键 | |
| C. | 与水反应的化学方程式可能为2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| D. | 为非极性分子 |
1.下列表示物质结构的化学用语或模型图正确的是( )
| A. | Cl原子结构示意图: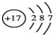 | B. | H2O2的电子式: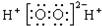 | ||
| C. | HClO的结构式H-O-Cl | D. | 14C的原子结构示意图: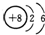 |
19.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与盐酸混合Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化铁与盐酸反应H++OH-=H2O | |
| C. | 氯化钡溶液与稀硫酸混合Ba2++SO42-=BaSO4↓ | |
| D. | 铝与硝酸汞溶液反应Al+Hg2+=Al3++Hg |
 、
、 、
、 、
、 、
、 .
.
 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.