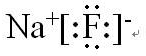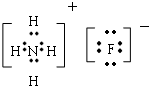题目内容
7.(1)相同条件下,等物质的量的CO2与CO气体,其体积之比为1:1;,质量之比为11:7,所含氧元素的质量之比为2:1.(2)用“双线桥”分析以下反应得失电子的情况:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
其中还原剂是HCl,被还原的元素是Cl,氧化产物是Cl2.(填化学式或元素符号)
(3)写出以下反应的离子方程式
①NaHCO3与盐酸反应HCO3-+H+=CO2↑+H2O
②氧化铝溶于稀硫酸Al2O3+6H+=2Al3++3H2O.
分析 (1)依据相同条件下,气体的物质的量之比等于体积之比,结合m=nM计算解答;
(2)氧化还原反应中,根据化合价的变化来判断电子转移情况;所含元素化合价升高的为还原剂,对应氧化产物;所含元素化合价降低的反应物为氧化剂,对应还原产物;
(3)①碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
②氧化铝与硫酸反应生成硫酸铝和水.
解答 解:(1)依据相同条件下,气体的物质的量之比等于体积之比,等物质的量的CO2与CO气体,其气体之比等于1:1;质量之比为=n×44:n×28=11:7;所含氧元素的质量之比为=2×n(CO2)×M(O):2×n(CO)×M(O)=2:1;
故答案为:1:1;11:7;2:1;
(2)KClO3中氯元素化合价由+5价降低为0价,失去5个电子,盐酸中,部分氯元素化合价由-1价升高为0价,氯化钾的生成表现了显酸性的盐酸,元素化合价升高值等于元素化合价降低值=电子转移数=5,电子转移情况为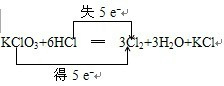 ,氯化氢中氯化合价升高,为还原剂,对应产物氯气为氧化产物;氯酸钾氯元素化合价降低,为氧化剂,氯元素被还原,对应还原产物为氯气;
,氯化氢中氯化合价升高,为还原剂,对应产物氯气为氧化产物;氯酸钾氯元素化合价降低,为氧化剂,氯元素被还原,对应还原产物为氯气;
故答案为: ;HCl;Cl;Cl2;
;HCl;Cl;Cl2;
(3)①碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式:HCO3-+H+=CO2↑+H2O;
故答案为:HCO3-+H+=CO2↑+H2O;
②氧化铝与硫酸反应生成硫酸铝和水,离子方程式:Al2O3+6H+=2Al3++3H2O;
故答案为:Al2O3+6H+=2Al3++3H2O.
点评 本题考查了物质的量之间计算、离子方程式的书写、氧化还原反应的基本概念,侧重考查学生对基础知识的掌握情况,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
15.甲烷和氯气以物质的量1:1混合,在光照条件下,得到的产物是( )
①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
| A. | 只有①⑤ | B. | ①②③④的混合物 | C. | 只有②⑤ | D. | ①②③④⑤的混合物 |
2.阅读下表中部分短周期主族元素的相关信息,请回答:
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).
(2)单质T与冷水反应的化学方程式为2Na+2H2O═2NaOH+H2↑
(3)将T的最高价氧化物对应水化物的溶液逐滴加入到Y与Z形成的化合物的溶液中,直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式Al3++4OH-═AlO2-+2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓.
| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所有金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).(2)单质T与冷水反应的化学方程式为2Na+2H2O═2NaOH+H2↑
(3)将T的最高价氧化物对应水化物的溶液逐滴加入到Y与Z形成的化合物的溶液中,直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式Al3++4OH-═AlO2-+2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓.
12.有A、B、C、D四种金属,投入水中只有D反应放出氢气,将A投入C的盐溶液中可置换出金属C,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强,则四种金属的金属性强弱顺序正确的是( )
| A. | A>B>C>D | B. | A>C>B>D | C. | A>C>D>B | D. | D>B>A>C |
19.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与盐酸混合Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化铁与盐酸反应H++OH-=H2O | |
| C. | 氯化钡溶液与稀硫酸混合Ba2++SO42-=BaSO4↓ | |
| D. | 铝与硝酸汞溶液反应Al+Hg2+=Al3++Hg |
10.在恒容密闭容器中,一定温度下,可逆反应A(s)+3B(g)?2C(g)+D(g)达到平衡状态的标志是( )
| A. | 混合气体的密度不再改变的状态 | |
| B. | 单位时间生成2n mol C,同时生成n mol D | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | A、B、C、D的分子数之比为1:3:2:1 |