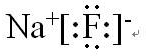题目内容
10.关于化学反应中能量变化的说法错误的是( )| A. | 如图所示的反应为吸热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热才有发生的反应一定是吸热反应 | |
| D. | 化学键断裂吸收能量,化学键生成放出能量 |
分析 A.根据图示中反应物与生成物能量高低进行判断;
B.化学反应一定有新物质的生成,同时一定伴随着能量变化;
C.很多放热反应,需要点燃或者加热才能使反应进行,溶液氧气与氢气的反应为放热反应,该反应需要点燃才能进行;
D.化学反应中,旧的化学键断裂需要吸收能量,新的化学键生成过程中会放出能量.
解答 解:A.由图示可知,在反应过程中,反应物总能量小于生成物总能量,该反应一定为吸热反应,故A正确;
B.有新的物质生成的反应为化学反应,所以化学反应一定有物质变化,并且反应过程中一定伴随着能量变化,通常以热量的形式释放出来,故B正确;
C.吸热反应不一定需要加热才能进行,如氢氧化钡晶体与氯化铵的反应;加热条件下能够进行的反应不一定为吸热反应,反应吸热还是放热与反应物和生成物总能量大小有关,与反应条件没有必然关系,故C错误;
D.化学反应中,旧的化学键断裂需要吸收能量,新的化学键生成会放出能量,所以化学反应中一定伴随着能量变化,故D正确;故选C.
点评 本题考查了化学反应与能量变化,题目难度不大,注意明确化学反应的实质,任何化学反应中一定伴随着能量变化,还要明确放热反应、吸热反应与反应条件没有必然关系.

练习册系列答案
相关题目
1.下列表示物质结构的化学用语或模型图正确的是( )
| A. | Cl原子结构示意图: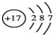 | B. | H2O2的电子式: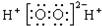 | ||
| C. | HClO的结构式H-O-Cl | D. | 14C的原子结构示意图: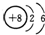 |
5.已知1g丙烷(C3H8)完全燃烧生成CO2气体和液态水,放出50.405kJ热量,则下列热化学方程式正确的是( )
| A. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-50.405 kJ•mol-1 | |
| B. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=+2 217.82 kJ•mol-1 | |
| C. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=+50.405 kJ•mol-1 | |
| D. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2 217.82 kJ•mol-1 |
15.甲烷和氯气以物质的量1:1混合,在光照条件下,得到的产物是( )
①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
①CH3Cl②CH2Cl2③CHCl3④CCl4⑤HCl.
| A. | 只有①⑤ | B. | ①②③④的混合物 | C. | 只有②⑤ | D. | ①②③④⑤的混合物 |
2.阅读下表中部分短周期主族元素的相关信息,请回答:
(1)元素T与X按原子个数比1:1形成的化合物B的电子式为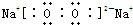 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).
(2)单质T与冷水反应的化学方程式为2Na+2H2O═2NaOH+H2↑
(3)将T的最高价氧化物对应水化物的溶液逐滴加入到Y与Z形成的化合物的溶液中,直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式Al3++4OH-═AlO2-+2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓.
| 元素代号 | 相关信息 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期的所有金属离子中,Y的离子半径最小 |
| Z | Z与Y同周期,是所在周期中原子半径最小的元素 |
| T | T的单质能与冷水剧烈反应,生成的强碱电离出两种电子数相等的阴、阳离子 |
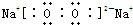 ,该化合物中所含的化学键有离子键、共价键(填化学键名称).
,该化合物中所含的化学键有离子键、共价键(填化学键名称).(2)单质T与冷水反应的化学方程式为2Na+2H2O═2NaOH+H2↑
(3)将T的最高价氧化物对应水化物的溶液逐滴加入到Y与Z形成的化合物的溶液中,直至过量(边滴加边振荡),写出此过程中发生反应的离子方程式Al3++4OH-═AlO2-+2H2O、Al3++3AlO2-+6H2O═4Al(OH)3↓.
19.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与盐酸混合Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化铁与盐酸反应H++OH-=H2O | |
| C. | 氯化钡溶液与稀硫酸混合Ba2++SO42-=BaSO4↓ | |
| D. | 铝与硝酸汞溶液反应Al+Hg2+=Al3++Hg |
13.常温下,将下列物质溶于水中分别配制成0.1mol•L-1溶液,所得溶液pH大于7的是( )
| A. | NaCl | B. | NaHSO4 | C. | NaHCO3 | D. | CH3COOH |
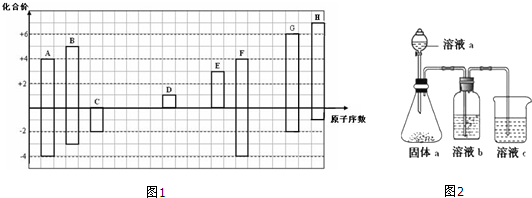
 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.