题目内容
6.下列四种工业生产:①用海水为原料制镁;②冶炼生铁;③制漂白粉;④工业制备普通玻璃.要用石灰石作为一种原料的( )| A. | 只有① | B. | 只有①②③ | C. | 只有②③ | D. | 全部 |
分析 ①从海水中提取镁的原料:海水、石灰乳;
②冶炼生铁的原料:铁矿石、焦炭、石灰石;
③制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉;
④制普通玻璃的原料:石英砂、石灰石、纯碱等.
解答 解:①从海水中提取镁的原料:用石灰石可以制得氧化钙进而得到石灰乳,海水,必需用到石灰石,故①正确;
②冶炼生铁的原料:铁矿石、焦炭、石灰石,必需用到石灰石,故②正确;
③制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉,必需用到石灰石,故③正确;
④制普通玻璃的原料:石英砂、石灰石、纯碱等,必需用到石灰石,故④正确;
故选D.
点评 本题考查工业生产的原理以及原料、难度不大,注意基础知识的积累.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
17.已知下列三个反应:2Fe3++2I-═2Fe2++I2;2Fe2++Cl2═2Fe3++2Cl-;2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O,某溶液中有Fe2+、Cl-和I-,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是( )
| A. | Cl2 | B. | KMnO4 | C. | 浓HCl | D. | FeCl3 |
1.下列各组物质中分子数一定相同的是( )
| A. | 2gO3和2 gO2 | B. | 9克H2O和0.5NA个CO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和4.48LHCl |
11.下列除去杂质的方法中错误的是( )
| 物质 | 杂质 | 除杂质的方法 | |
| A | SiO2 | CaCO3 | 过量稀硫酸、过滤 |
| B | 铜粉 | 铝粉 | 过量CuCl2溶液、过滤 |
| C | FeCl3溶液 | FeCl2 | 通入适量氯气 |
| D | SO2 | HC1 | 通过NaHSO3溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
18.(1)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: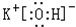 .
.
(2)在盛有500mL 0.1mol/LCuSO4溶液的大烧杯中.用锌、铜作电极,用导线连接形成原电池,写出电极反应式:负极Zn-2e-=Zn2+; 正极Cu2++2e-=Cu.
(3)过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是B
A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
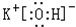 .
.(2)在盛有500mL 0.1mol/LCuSO4溶液的大烧杯中.用锌、铜作电极,用导线连接形成原电池,写出电极反应式:负极Zn-2e-=Zn2+; 正极Cu2++2e-=Cu.
(3)过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是B
A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸.
16.日前中国量子物质科学协同创新中心的江颖课题组和王恩哥课题组合作,在水科学领域取得重大突破,在国际上首次实现了水分子的亚分子级分辨成像,使得解析水的氢键网络构型成为可能.(图a是实验器件示意图,图b是拍摄到的图片的一部分,图c是图b所对应的结构示意图)下列有关说法不正确的是( )

| A. | 图a所示实验器件中,用氯化钠作为绝缘薄膜层,是因为氯化钠晶体不导电 | |
| B. | 图b是表示一个H2O分子内部的氢键和氢氧共价键结构特征示意图 | |
| C. | 水分子间形成氢键使水的熔点和沸点升高 | |
| D. | H2O分子的稳定性很强,是因为分子内氢氧共价键强 |
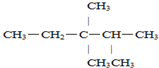 2,3,3-三甲基戊烷;
2,3,3-三甲基戊烷;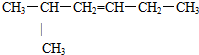 2-甲基-3-己烯;
2-甲基-3-己烯;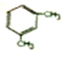 1,3-二甲基苯.(用系统命名法命名)
1,3-二甲基苯.(用系统命名法命名)