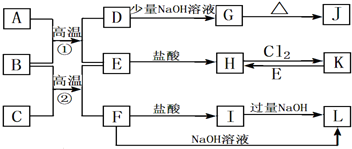
题目内容
18.(1)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在盛有500mL 0.1mol/LCuSO4溶液的大烧杯中.用锌、铜作电极,用导线连接形成原电池,写出电极反应式:负极Zn-2e-=Zn2+; 正极Cu2++2e-=Cu.
(3)过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是B
A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸.
分析 (1)由元素在周期表中的位置可知,①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,非金属性最强,最高价氧化物的水化物酸性最强,金属性最强,最高价氧化物的水化物碱性最强;
(2)用锌、铜作电极,锌较活泼,为原电池的负极,发生氧化反应,铜为正极发生还原反应;
(3)根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,以此来解答.
解答 解:(1)由元素在周期表中的位置可知,①为C,②为N,③为O,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,最高价氧化物的水化物中,酸性最强的化合物的分子式为HClO4;碱性最强的化合物为KOH,其电子式是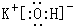 ,
,
故答案为:HClO4;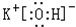 ;
;
(2)用锌、铜作电极,锌较活泼,为原电池的负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,正极发生还原反应,电解质为 0.1mol/LCuSO4溶液,发生Cu2++2e-=Cu,
故答案为:Zn-2e-=Zn2+;Cu2++2e-=Cu;
(3)A.升高反应体系温度,反应速率增大,不影响生成氢气的总量,故A错误;
B.加水,加水,氢离子的浓度减小,减缓反应速率,但又不影响生成氢气的总量,故B正确;
C.加入少量CuSO4溶液,锌与硫酸铜反应置换出铜,形成原电池,反应速率加快,因为是过量的锌粉,所以不影响生成的氢气总量,故C错误;
D.加入浓度较大的盐酸,氢离子的浓度增大,加快反应速率,但氢离子的物质的量增多,会影响生成氢气的总量,故D错误;
故答案为:B.
点评 本题考查元素周期表和元素周期律、原电池、影响化学反应速率的因素等知识,明确元素的位置推断出各元素、掌握原电池工作原理、明确温度、浓度、接触面积对反应速率的影响是解答的关键,注意化学用语的应用,题目难度不大.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案A.CuO、CO2、SO2、H2O B. Cl2、Na、Fe、Cu
C.HCl、HNO3、H2SO4、H2O D.Na2CO3、KCl、NaOH、AgNO3
| A组 | B组 | C组 | D组 | |
| 分类标准 | 非金属氧化物 | 金属单质 | 酸 | 盐 |
| 不属于该类别的物质 | CuO | Cl2 | H2O | NaOH |
| A. | 生成 SO3 为2mol | |
| B. | 单位时间消耗amol O2,同时消耗2amol SO2 | |
| C. | SO2 和 SO3物质的量之和一定为 2mol | |
| D. | SO2和SO3的浓度一定相等 |
| A. | 只有① | B. | 只有①②③ | C. | 只有②③ | D. | 全部 |
| A. | 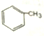 | B. | HC≡C-CH2-CH3 | C. | CH2=C(CH3)2 | D. | CH2=CHCH=CH2 |
| A. | PCl5 | B. | NO2 | C. | NF3 | D. | H2O |
| A. | Cl2 | B. | O2 | C. | SO2 | D. | NO2 |