题目内容
1.下列各组物质中分子数一定相同的是( )| A. | 2gO3和2 gO2 | B. | 9克H2O和0.5NA个CO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和4.48LHCl |
分析 含有分子数目相等,则其物质的量相等.
A.根据n=$\frac{m}{M}$计算判断;
B.根据n=$\frac{m}{M}$计算水的物质的量,根据n=$\frac{N}{{N}_{A}}$计算二氧化碳物质的量;
C.标况下水不是气体;
D.HCl所处的温度、压强未知.
解答 解:A.根据n=$\frac{m}{M}$可知,2gO3和2 gO2的物质的量之比为32g/mol:48g/mol=2:3,含有分子数目不相等,故A错误;
B.9g水的物质的量为$\frac{9g}{18g/mol}$=0.5mol,0.5NA个CO2的物质的量为0.5mol,二者含有分子数目相等,故B正确;
C.标况下水不是气体,22.4L水的物质的量远远大于1mol,故C错误;
D.HCl所处的温度、压强未知,不能确定4.48LHCl的物质的量是否为0.2mol,故D错误,
故选:B.
点评 本题考查物质的量有关计算,比较基础,注意气体摩尔体积的使用条件与对象.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
11.甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(p)的关系如图甲所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”“<”或“=”).
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).500℃时测得反应③在某时刻时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”“=”或“<”).
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)-t(反应时间)变化曲线Ⅰ如图乙所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ
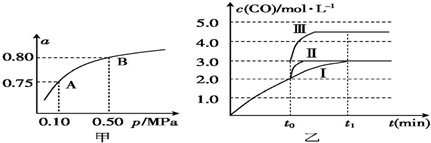
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂
当曲线Ⅰ变为曲线Ⅲ时,改变的条是将容器的体积快速压缩至2L.
| 化学反应 | 平衡常温 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.5 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(p)的关系如图甲所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”“<”或“=”).
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).500℃时测得反应③在某时刻时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”“=”或“<”).
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)-t(反应时间)变化曲线Ⅰ如图乙所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ

当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂
当曲线Ⅰ变为曲线Ⅲ时,改变的条是将容器的体积快速压缩至2L.
12.物质的提纯是化学实验中的一项重要操作,也是化工生产及物质制备中的主要环节.下列有关叙述中,正确的是( )
| A. | 除去乙烷中少量的乙烯,可将混合气体通入酸性高锰酸钾溶液 | |
| B. | 除去苯中含有的少量苯酚,可加入浓溴水过滤,即可除去苯酚 | |
| C. | 乙酸乙酯中混有乙酸,可用饱和Na2CO3溶液洗涤,然后分液分离出乙酸乙酯 | |
| D. | 在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓CuSO4溶液,然后滤出沉淀,即得较纯的蛋白质 |
9.一定温度下,将 2mol SO2 和 1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)当达到平衡状态时,下列说法中正确的是( )
| A. | 生成 SO3 为2mol | |
| B. | 单位时间消耗amol O2,同时消耗2amol SO2 | |
| C. | SO2 和 SO3物质的量之和一定为 2mol | |
| D. | SO2和SO3的浓度一定相等 |
6.下列四种工业生产:①用海水为原料制镁;②冶炼生铁;③制漂白粉;④工业制备普通玻璃.要用石灰石作为一种原料的( )
| A. | 只有① | B. | 只有①②③ | C. | 只有②③ | D. | 全部 |
10.下列有机化合物分子中的所有碳原子不一定处于同一平面的是( )
| A. | 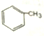 | B. | HC≡C-CH2-CH3 | C. | CH2=C(CH3)2 | D. | CH2=CHCH=CH2 |
11.苯丙酸诺龙是一种兴奋剂,结构简式为有关苯丙酸诺龙的说法不正确的是( )
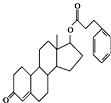

| A. | 含有两种官能团 | B. | 含有脂环 | ||
| C. | 是一种芳香化合物 | D. | 含有酯基 |