题目内容
14.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:(已知 氨可以与灼热的氧化铜反应得到氮气和金属铜.方程式见下):[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
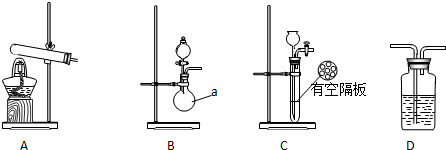
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4. |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 分析氢氧化钠的作用:③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出. |
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
分析 (1)根据装置图可知仪器a的名称;
(2)利用装置压强差产生的现象判断装置气密性;
(3)氢氧化钙、硫酸铵反应生成硫酸钙和氨气,根据元素守恒书写化学方程式;乙小组是用液体与固体作用不加热,据此选择装置;氢氧化钠固体溶解放热促进氨水溶液中平衡向放氨气的方向进行,同时氢氧化钠溶液显碱性,可以抑制氨水电离,促使氨气放出;
(4)根据氧化铜中氧元素的质量等于生成的水中氧元素的质量,可以计算出氧的物质的量,根据氮气的体积计算出氮气的物质的量,从而求出氮原子的物质的量,进而计算出氮、氢的原子个数之比;
(5)根据浓硫酸的吸水性及能与氨气反应进行分析.
解答 解:(1)仪器a的名称为:圆底烧瓶,故答案为:圆底烧瓶;
(2)检查A装置气密性的具体操作方法是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱,
故答案为:连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱;
(3)①氢氧化钙与硫酸铵反应生成硫酸钙、氨气和水,反应的化学方程式为(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4,
故答案为:(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4;
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,氨气挥发放出气体,故选B装置;
③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出,
故答案为:氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出;
(4)反应前氧化铜的质量为m1g、氧化铜反应后转化成的铜的质量为m2g,则氧化铜中氧元素的质量为m1-m2,生成的水中氧元素的质量等于氧化铜氧元素的质量,则生成的水中氧原子的个数为$\frac{m{\;}_{1}-m{\;}_{2}}{16}$;水中氢原子个数是氧原子个数的两倍,因此氢原子个数为$\frac{m{\;}_{1}-m{\;}_{2}}{16}$×2,生成的氮气在标准状况下的体积V1L,则氮气中氮原子的个数为$\frac{V{\;}_{1}×2}{22.4}$;
因此氮氢原子个数比为$\frac{V{\;}_{1}×2}{22.4}$:$\frac{m{\;}_{1}-m{\;}_{2}}{16}$×2=5V1:7(m1-m2),
故答案为:5V1:7(m1-m2);
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高. 因此在 洗气瓶D前的位置应增加了一个装有碱石灰(无水硫酸铜、氢氧化钠、氧化钙等)的实验仪器只吸收水,减小误差,
故答案为:洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高;碱石灰(氢氧化钠、氧化钙等).
点评 本题是一道综合性很强的实验探究题,要求学生具有分析和解决问题的能力,主要是物质探究物质组成和方法的应用,难度较大.

| A. | SO2 | B. | NO | C. | NO2 | D. | CO2 |
| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产有利 | |
| D. | 电解时溶液中I-向阴极迁移 |
| A. | CH3CH2CH2CH3(3组) | B. | CH2═CH-CH2CH3(2组) | ||
| C. | 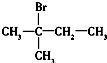 (4组) (4组) | D. | 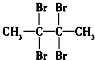 (1组) (1组) |
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体(如H2、CO等)时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | ①②③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 全部 |
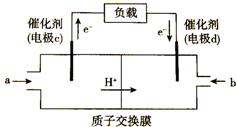 (1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)如图是用于笔记本电脑的甲醇燃料电池结构示意图,a处充入的物质是甲醇(写名称),写出此电极的电极反应式CH3OH-6e-+H2O=CO2+6H+.(2)若以该电池为电源,用石墨做电极电解200mL含有下列离子的溶液,
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
