题目内容
4.过碳酸钠(2Na2CO3•3H2O2 )俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂.某兴趣小组制备过碳酸钠的制备流程如下:
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是降低过碳酸钠的溶解度,有利于过碳酸钠晶体析出.
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+杂质生成稳定的配合物的目的是防止Fe3+杂质离子催化H2O2分解.
(3)洗涤抽滤产品,应选用合适的洗涤试剂是C(填写序号).
A.饱和氯化钠溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)工业上常以活性氧的质量分数[ω(活性氧)=16n(H2O2)/m(样品)×100%]来衡量过碳酸钠产品的优劣,ω≥13%为优等品.现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol•L-1Na2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL.(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程).
分析 本题是工业制过碳酸钠的流程,过碳酸钠具有过氧化氢及碳酸钠的性质,过氧化氢除强氧化性外,还具有遇Fe3+等重金属阳离子催化易分解,本身受热也不稳定的特性,因此制备过程中要防止过氧化氢的分解,另外为提高产品的产量和纯度,要选择适宜的结晶、洗涤操作等措施;
(1)因过碳酸钠易溶解于水,可利用盐析原理,结果过程中不断添加氯化钠晶体颗粒,抑制过碳酸钠溶解;
(2)双氧水可在Fe3+催化作用下快速分解,因此要除去杂质Fe3+离子的干扰;
(3)根据相似相溶原理分析,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂;
(4)利用滴定原理H2O2+2KI+H2SO4=2H2O+I2+K2SO4,建立关系式计算样品ω(活性氧),判断样品的优劣.
解答 解:(1)结晶过程中加入氯化钠、搅拌,能降低过碳酸钠的溶解度,有利于过碳酸钠析出,故答案为:降低过碳酸钠的溶解度,有利于过碳酸钠析出;
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+杂质生成稳定的配合物的,除去溶液里的Fe3+,防止双氧水在Fe3+催化作用下快速分解,故答案为:防止Fe3+杂质离子催化H2O2分解;
(3)根据相似相溶原理知,过碳酸钠易溶于水或水溶液,难溶于有机溶剂,且易分离,故选C;
(4)根据题目可知发生的化学反应为:H2O2+2KI+H2SO4=2H2O+I2+K2SO4由关系式H2O2~I2~2 Na2S2O3可得出n(H2O2)=1.65×10-3mol,
ω(活性氧)=16n(H2O2)/m(样品)×100%=16×1.65×10-3 mol÷0.2000g×100%=13.2%>13%,此样品是优等品,故答案为:样品为优等品.
点评 本题考查实验方案设计,根据物质的性质来分析解答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列关于元素及其化合物的说法正确的是( )
| A. | 光导纤维的主要成分为硅单质 | |
| B. | Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 | |
| C. | Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 | |
| D. | 制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法 |
3.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2FeCl2═2FeCl3 | D. | 3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3 |
12.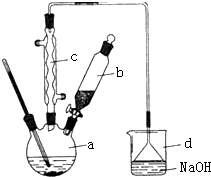 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
(1)写出a中生成溴苯的化学方程式 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加至液溴滴完.装置d装置的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯;要进一步提纯,下列操作中必须的是D(填入正确选项前的字母).
A.重结晶 B.过滤 C.萃取 D.蒸馏.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加至液溴滴完.装置d装置的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯;要进一步提纯,下列操作中必须的是D(填入正确选项前的字母).
A.重结晶 B.过滤 C.萃取 D.蒸馏.
14.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:(已知 氨可以与灼热的氧化铜反应得到氮气和金属铜.方程式见下):
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
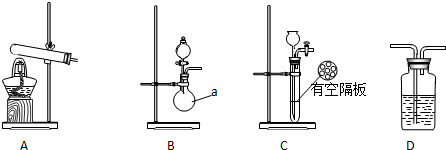
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4. |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 分析氢氧化钠的作用:③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出. |
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
 某油脂化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及其氧化物,其他不溶杂志(3.3%).由含镍废催化剂制取NiSO4.7H20的流程如图:
某油脂化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及其氧化物,其他不溶杂志(3.3%).由含镍废催化剂制取NiSO4.7H20的流程如图: (Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.
(Ⅰ)一研究性学习小组对某工业城市的空气污染进行了下列研究.