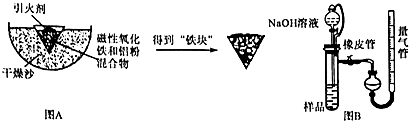
题目内容
5.(1)下列化学反应在理论上可以设计成原电池的是C.A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为O2+4H++4e-=2H2O.
分析 (1)常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
(2)正极上发生还原反应,氧气得到电子结合氢离子反应生成水,据此写出正极的电极反应式.
解答 解:(1)能设计成原电池的反应通常是放热反应,
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,该反应为氧化还原反应,且为放热反应,能设计为原电池,故C正确;
故答案为:C;
(2)电极总反应为2H2(g)+O2(g)=2H2O(1)△H<0,以H2SO4溶液为电解质溶液,氢氧燃料电池的正极上氧气得到电子结合氢离子生成水,其电极反应式为:O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O.
点评 本题考查原电池的设计和燃料电池的电极反应书写,题目难度中等,明确原电池与氧化还原反应的关系及负极发生氧化反应是解答本题的关键,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
3.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2FeCl2═2FeCl3 | D. | 3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3 |
20.下列离子方程式中,正确的是( )
| A. | 向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+═Mg(OH)2↓ | |
| B. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| C. | 酸性KMnO4溶液与H2O2反应:2MnO${\;}_{4}^{-}$+10H++3H2O2═2Mn2++3O2↑+8H2O | |
| D. | 向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++3NO↑+5I2+6H2O |
14.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:(已知 氨可以与灼热的氧化铜反应得到氮气和金属铜.方程式见下):
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
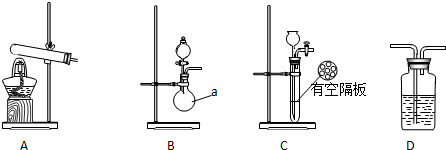
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4. |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 分析氢氧化钠的作用:③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出. |
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
15.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | NaWO是漂白粉的有效成分 | |
| B. | 原子半径由小到大的顺序:X<Y<Z<W | |
| C. | 室温下,0.1mol/L W的气态氢化物的水溶液的pH>1 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |