题目内容
3.以下关于化学实验中“先与后”的说法中正确的是( )①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取气体时,先检验装置气密性后装药品
④点燃可燃性气体(如H2、CO等)时,先检验气体纯度后点燃
⑤做H2还原CuO实验时,先通H2后加热CuO,反应完毕后,先撤酒精灯待试管冷却后停止通H2.
| A. | ①②③⑤ | B. | ①②④⑤ | C. | ①②③④ | D. | 全部 |
分析 ①先均匀加热,后局部加热可防止试管局部过热而炸裂;
②要先撤出导管,然后熄灭酒精灯,以免引起倒吸;
③先检查装置的气密性,否则会造成药品的浪费;
④点燃可燃性气体时要先验纯,以防发生爆炸;
⑤H2还原CuO时要先通H2,排净系统内的空气
解答 解:①加热试管时,先均匀加热,后局部加热可防止试管局部过热而炸裂,故①正确;
②用排水法收集气体时,要先撤出导管,然后熄灭酒精灯,以免引起倒吸,故②正确;
③制取气体物质时,要先检查装置的气密性,否则会造成药品的浪费,故③正确;
④点燃可燃性气体时要先验纯,以防发生爆炸,发生危险,故④正确;
⑤H2还原CuO时要先通H2,排净系统内的空气,若先加热再通H2会引起爆炸,实验完毕后仍需通H2以待试管冷却,若立即停止通H2,会引起氧化,故⑤正确;
故选D.
点评 本题考查常见仪器的使用,难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
14.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:(已知 氨可以与灼热的氧化铜反应得到氮气和金属铜.方程式见下):
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
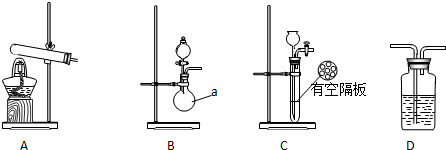
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为5V1:7(m1-m2).
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
[制取氨气]→[装有足量干燥剂的干燥管]→装有氧化铜的硬质玻管]→[装有足量浓硫酸的洗气瓶]→[测定生成]
氮的体积制取氨气装有足量干燥剂的 干 燥 管装有氧化铜的硬质玻管装有足量浓硫酸的洗气瓶 测定生成氮的体积
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$ 3Cu+N2+3H2O
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完毕后,黑色的氧化铜转化为红色的铜.如图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶.

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L.
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氮气在标准状况下的体积V2L. 请回答下列问题:
(1)写出仪器a的名称圆底烧瓶.
(2)检查A装置气密性的操作是连接导管,将导管插入水中,用手紧握试管或加热试管,导管口有气泡产生,松开手后或停止加热,导管内有水回流并形成一段稳定的水柱.
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为①(NH4)2SO4+Ca(OH)2═2NH3↑+2H2O+CaSO4. |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 分析氢氧化钠的作用:③氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3•H2O?NH4++OH-向逆方向移动,加快氨气逸出. |
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了未反应的氨气,从而使计算的氢的量偏高.为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出了合理的实验结果.该药品的名称是碱石灰(氢氧化钠、氧化钙等).
18.下列说法或表示法正确的是( )
| A. | 等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.19 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热 |
8.下列叙述正确的是( )
| A. | 用结晶的方法分离氯化钠和硝酸钾的混合物 | |
| B. | 将液态物质加热至沸点,使之汽化,再重新冷凝为液体的操作过程称为蒸发 | |
| C. | 用分液的方法分离酒精和水的混合物 | |
| D. | 做焰色反应后,铂丝用稀硫酸洗涤,然后再放在火焰上灼烧至无色 |
15.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | NaWO是漂白粉的有效成分 | |
| B. | 原子半径由小到大的顺序:X<Y<Z<W | |
| C. | 室温下,0.1mol/L W的气态氢化物的水溶液的pH>1 | |
| D. | Y单质在一定条件下可以与氧化铁发生置换反应 |
13.下列有关化学反应速率的说法正确的是( )
| A. | 用铁片与稀硫酸反应制取氢气时,改用浓硫酸可以加快产生氢气的速率 | |
| B. | 10 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加 |
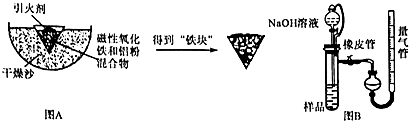
 某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程.
某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程.