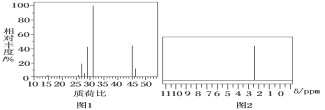
题目内容
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示,下列有关说法不正确的是( )
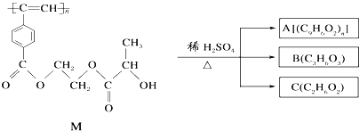
(注:A、B、C分子式分别为![]() C9H6O2
C9H6O2![]() 、C3H6O3、C2H6O2)
、C3H6O3、C2H6O2)
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1:2:2
D. 1molM与热的烧碱溶液反应,可消耗2n mol NaOH
【答案】C
【解析】
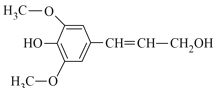
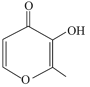
M中含-COOC-,水解得到A为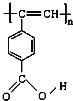 ,C为HOCH2CH2OH,B为
,C为HOCH2CH2OH,B为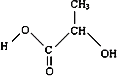 ,
,
A.M、A中均含碳碳双键,则均能使酸性高锰酸钾溶液和溴水褪色,故A项正确;
B.B中含-OH、-COOH,-OH可发生消去反应,-OH、-COOH可发生酯化反应,故B项正确;
C.由2-COOH~2-OH~H2↑可知,A、B、C各1mol分别与金属钠反应,放出的气体的物质的量之比为n:2:2,故C项错误;
D.1molM中含2nmol-COOC-,则1molM与热的烧碱溶液反应,可消耗2n mol的NaOH,故D项正确。
故答案选C。

练习册系列答案
相关题目
【题目】用阳极X和阴极Y电解足量Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
选项 | 阳极X | 阴极Y | Z | W |
A | C | Fe | KCl | KOH |
B | Pt | Cu | CuSO4 | Cu(OH)2溶液 |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3晶体 |
A. AB. BC. CD. D