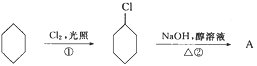
题目内容
【题目】(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 升华 C 结晶 D 过滤 E 蒸馏 F 分液
①分离饱和食盐水与沙子的混合物______;
②从硝酸钾和氯化钠的混合液中获得硝酸钾______;
③从碘水中提取碘单质______;
④分离水和汽油的混合物______;
⑤分离![]() 沸点为
沸点为![]() 和甲苯
和甲苯![]() 沸点为
沸点为![]() 的混合物______。
的混合物______。
(2)0.4 mol某气体的体积为9.8L,则该气体的气体摩尔体积为_____。
(3)标准状况下,测得1.92克某气体的体积为672mL,则此气体的相对分子质量为___。
(4)实验室用Na2CO3·10H2O晶体配制0. 5mol/L的Na2CO3溶液970mL,应用托盘天平称取Na2CO3·10H2O的质量是____。
(5)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7mol AOH与5mol BOH混合后,从中取出5.6g,恰好可以中和100ml浓度为1.2mol/L的盐酸,则AOH的摩尔质量为_____。
(6)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要用量筒量取____mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是____(填序号)。
a 用量筒量取浓盐酸时俯视观察凹液面
b 将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c 稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e 容量瓶洗涤干净后未干燥
【答案】D C A F E 24.5Lmol-1 64 143.0g 40g/mol 12.5 ad
【解析】
(1)①不溶于水的固体和溶液的分离,采用过滤的方法,故选D;
②硝酸钾和氯化钠都溶于水,但二者在水中的溶解度不同,可用结晶的方法分离,故选C;
③从碘水中提取碘单质采用萃取分液的方法,故选A;
④汽油和水不互溶,二者混合分层,所以可以采用分液的方法分离,故选F;
⑤四氯化碳和甲苯互溶且属于沸点不同的液体,所以可以采用蒸馏的方法分离,故选E;
(2)根据n=![]() ,则该状况下气体摩尔体积Vm=
,则该状况下气体摩尔体积Vm=![]() =
=![]() =24.5 L/mol,故答案为:24.5L/mol;
=24.5 L/mol,故答案为:24.5L/mol;
(3)n=![]() =
=![]() =0.03mol,M=
=0.03mol,M=![]() =
=![]() =64g/mol,则相对分子质量为64,故答案为:64;
=64g/mol,则相对分子质量为64,故答案为:64;
(4)实验室用Na2CO310H2O晶体配制0.5mol/L的Na2CO3溶液970mL,因为实验室没有970mL的容量瓶,所以应选择1000mL容量瓶配制,实际配制1000mL溶液,需要Na2CO310H2O的质量m=0.5mol/L×1L×286g/mol=143.0g,故答案为:143.0;
(5)设AOH和BOH的摩尔质量分别为5x g/mol和7x g/mol,
n(HCl)=n(OH-)=0.1×1.2=0.12mol;7mol AOH与5mol BOH混合物中含有n(OH-)=7+5=12,根据题意可知,5.6g混合碱中含有n(OH-)=0.12mol,则含有n(OH-)=12mol时,混合碱的质量为560g;根据7mol×5x g/mol+5mol×7x g/mol=560g可知,x=8,所以AOH的摩尔质量为40g/mol;
故答案是:40g/mol;
(6)①设需要浓盐酸体积为V,稀释前后溶液中溶质的物质的量不变:V×12mol/L=0.3mol/L×500mL,解得V=12.5 mL,故答案为:12.5;
②a、用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,溶质的物质的量偏小,溶液的浓度偏小,故a选;
b、将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中,导致量取的浓盐酸体积偏大,溶质的物质的量偏大,故b不选;
c、稀释浓盐酸时,未冷却到室温即转移到容量瓶中,冷却后液面下降,溶液体积偏小,溶液浓度偏大,故c不选;
d、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,导致溶液体积偏大,溶液浓度偏小,故d选;
e、容量瓶洗涤干净后未干燥,对溶质的量和溶液体积都不产生影响,溶液浓度不变,故e不选;
故答案为:ad。