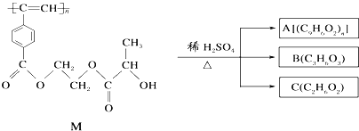
题目内容
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
(1)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
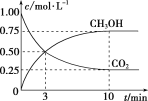
①0~10 min内,氢气的平均反应速率为____________,第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________(填“正向”“逆向”或“不”)移动。
②若已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1;2H2(g)+O2(g)===2H2O(g) ΔH=-b kJ·mol-1;H2O(g)===H2O(l) ΔH=-c kJ·mol-1;CH3OH(g)===CH3OH(l) ΔH=-d kJ·mol-1。则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)如图,25 ℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解600 mL一定浓度的NaCl溶液,电池的负极反应式为_________________________________。
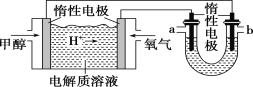
在电解一段时间后,NaCl溶液的 pH 变为12(假设电解前后NaCl溶液的体积不变,阳极产物只有Cl2),则理论上消耗甲醇的物质的量为________mol。
(3)向(2)U形管内电解后的溶液(假设NaCl溶液完全被电解)中通入标准状况下89.6 mL 的CO2气体,则所得溶液呈________(填“酸”“碱”或“中”)性,溶液中各离子浓度由大到小的顺序_________。
【答案】0.225 mol·L-1·min-1 正向 CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l)ΔH=-(
O2(g)===CO2(g)+2H2O(l)ΔH=-(![]() b+2c-a-d) kJ·mol-1 CH4O -6e-+ H2O = CO2+6H+ 0.001 碱 c(Na+ ) >c(HCO3—) >c(CO32—) >c(OH-) >c(H+)
b+2c-a-d) kJ·mol-1 CH4O -6e-+ H2O = CO2+6H+ 0.001 碱 c(Na+ ) >c(HCO3—) >c(CO32—) >c(OH-) >c(H+)
【解析】
(1)①三行式法计算,并且计算平衡常数;利用QC与K之间的关系判断平衡移动方向;
②利用盖斯定律计算;注意可燃物甲醇系数必须为1,产物水必须为液态;
(2)根据负极为甲醇失电子,注意酸性环境,写出电极反应式;根据转移电子数相等计算;
(3)二氧化碳与碱反应,先确定反应产物,再比较离子浓度。
(1)①图示甲醇初始浓度为1mol/L和甲醇投入量1mol可知容器容积为1L;列三行式:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
C初 1 3 0 0
△C 0.75 2.25 0.75 0.75
C平 0.25 0.75 0.75 0.75
v(H2)=△C氢气/△t=![]() =0.225mol/(L.min)
=0.225mol/(L.min)
K=![]() ≈5.33
≈5.33
Qc= ![]() =≈2.49<K,所以平衡正向移动;
=≈2.49<K,所以平衡正向移动;
答案:0.225 mol·L-1·min-1 正向
② ① CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1;
②2H2(g)+O2(g)===2H2O(g) ΔH=-b kJ·mol-1;
③H2O(g)===H2O(l) ΔH=-c kJ·mol-1;
④CH3OH(g)===CH3OH(l) ΔH=-d kJ·mol-1。
根据盖斯定律:②×3/2+③×2-④-①,可得CH3OH(l)燃烧热的热化学方程式 CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l)ΔH=-(
O2(g)===CO2(g)+2H2O(l)ΔH=-(![]() b+2c-a-d) kJ·mol-1;
b+2c-a-d) kJ·mol-1;
答案: CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l)ΔH=-(
O2(g)===CO2(g)+2H2O(l)ΔH=-(![]() b+2c-a-d) kJ·mol-1
b+2c-a-d) kJ·mol-1
(2)原电池:负极:CH4O -6e-+ H2O = CO2+6H+ 正极:3/2O2+6H++6e-=3H2O
电解池:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ pH=12说明氢氧根离子浓度为0.01mol/L,则生成氢氧根离子物质的量为0.01mol/L×600×10-3L=0.006mol;
2NaOH+H2↑+Cl2↑ pH=12说明氢氧根离子浓度为0.01mol/L,则生成氢氧根离子物质的量为0.01mol/L×600×10-3L=0.006mol;
根据转移电子数相等列关系式:6e-~6NaOH ~ CH4O
6mol 1mol
0.006mol n
计算得n(CH4O)=0.001mol;
答案:CH4O -6e-+ H2O = CO2+6H+ 0.001
(3)n(CO2)=V/Vm=![]() 0.004mol,n(NaOH)=0.006mol;假设二氧化碳通入氢氧化钠溶液生成碳酸钠xmol,碳酸氢钠ymol;
0.004mol,n(NaOH)=0.006mol;假设二氧化碳通入氢氧化钠溶液生成碳酸钠xmol,碳酸氢钠ymol;
根据钠元素的守恒:2x+y=0.006; 根据碳元素守恒:x+y=0.004;
解得:x=0.002mol y=0.002mol,溶液为碳酸钠与碳酸氢钠1:1的混合溶液,所以溶液显碱性,由于CO32-+H2O![]() HCO3-+OH-,使得CO32-的浓度比HCO3-的浓度略微小一些,故离子浓度c(Na+ ) >c(HCO3—) >c(CO32—) >c(OH-) >c(H+);
HCO3-+OH-,使得CO32-的浓度比HCO3-的浓度略微小一些,故离子浓度c(Na+ ) >c(HCO3—) >c(CO32—) >c(OH-) >c(H+);
答案:c(Na+ ) >c(HCO3—) >c(CO32—) >c(OH-) >c(H+)

【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
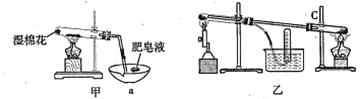
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________
(2)该反应为_______反应(选填吸热、放热);
(3)下列能使CO2的转化率增加的是___________________
(a)增大压强 (b)增加CO2的含量
(c)分离出产物H2O (d)升高温度
(4)830K时,若起始时:c(CO2)=2mol/L,c(H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为_________________
(5)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)混合气体的摩尔质量不变
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
编号 | 化学反应 | 离子方程式 | 评价 |
| 碳酸钙与醋酸反应 |
| 错误,碳酸钙是弱电解质,不应写成离子形式 |
| 向 |
| 错误,碱过量,应生成 |
|
|
| 正确 |
| 等物质的量的 |
| 正确 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()